K Dop (binne): 2 elektrone maksimum. L Dop: maksimum 8 elektrone. M Dop: 18 elektrone maksimum. N Dop: 32 elektrone maksimum. O Dop: 50 elektrone maksimum. P Dop (buitenste): 72 elektrone maksimum. 
As die valensiedop vol is, dan is die element stabiel. As die valensdop nie vol is nie, is die element reaktief, wat beteken dat dit `n chemiese binding met die atoom van `n ander element kan vorm. Elke atoom deel sy valenselektrone in `n poging om die valensdop vol te maak. 

Waterstof (H) en Helium (He) het albei 1 dop, terwyl Francium (Fr) 7 het. Die lantaniede en aktiniede word gegroepeer en onder die hooftabel gelys. Alle lantaniede behoort aan Periode 6, Groep 3 en alle aktiniede behoort aan Periode 7, Groep 3. 
Groep 1: 1 valenselektron Groep 2: 2 valenselektrone Groep 13: 3 valenselektrone Groep 14: 4 valenselektrone Groep 15: 5 valenselektrone Groep 16: 6 valenselektrone Groep 17: 7 valenselektrone Groep 18: 8 valenselektrone – behalwe Helium, wat 2 het 

Groep 3: 3 valenselektrone Groep 4: 2 tot 4 valenselektrone Groep 5: 2 tot 5 valenselektrone Groep 6: 2 tot 6 valenselektrone Groep 7: 2 tot 7 valenselektrone Groep 8: 2 of 3 valenselektrone Groep 9: 2 of 3 valenselektrone Groep 10: 2 of 3 valenselektrone Groep 11: 1 of 2 valenselektrone Groep 12: 2 valenselektrone
Bepaling van die aantal valenselektrone
Inhoud
Valenselektrone is in die buitenste dop van `n element geleë. Die aantal valenselektrone in `n atoom bepaal die tipe chemiese binding wat hierdie element kan vorm. Die beste manier om die aantal valenselektrone uit te vind, is om die periodieke tabel van die elemente te gebruik.
Trappe
Metode 1 van 3: Deel Een: Begrip van elektronskulpe

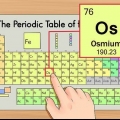
1. Die Periodieke Tabel van die Elemente. Dit is `n tabel van kleurkodes, waarin elke sel `n element met sy atoomgetal en 1 tot 3 letters as `n simbool toon.

2. Vind die atoomgetal van die element. Die atoomgetal is bo of langs die element se simbool. Byvoorbeeld: Boor (B) het atoomgetal 5, wat beteken dit het 5 protone en 5 elektrone.

3. Teken `n eenvoudige voorstelling van `n atoom en plaas die elektrone in `n wentelbaan om die kern. Hierdie bane word ook skulpe of energievlakke genoem. Die maksimum aantal elektrone wat in dieselfde dop kan wees, is vas, en die skulpe word van die binneste na die buitenste baan gevul.

4. Vind die aantal elektrone in die buitenste dop. Dit is die valenselektrone.
Metode 2 van 3: Deel Twee: Vind valenselektrone in metale behalwe oorgangsmetale

1. Nommer elke kolom van die periodieke tabel, van 1 tot 18. Waterstof (H) is boaan kolom 1 en Helium (He) is boaan kolom 18. Dit is die verskillende groepe elemente.

2. Nommer elke ry, van 1 tot 7. Dit is die periodes van die elemente, en dit stem ooreen met die aantal skulpe of energievlakke van `n atoom.

3. Vind `n element wat nie `n oorgangsmetaal is nie. Oorgangsmetale is in groepe 3 tot 12. Die groepnommers van die ander metale dui die aantal valenselektrone aan.
Metode 3 van 3: Deel Drie: Vind valenselektrone in oorgangsmetale

1. Vind `n element uit groepe 3 tot 12, die oorgangsmetale.

2. Bepaal die aantal valenselektrone gebaseer op die groepnommer. Hierdie groepgetalle stem ooreen met `n moontlike aantal valenselektrone.
Wenke
- Oorgangsmetale kan valensdoppies hê wat nie heeltemal vol is nie. Om die presiese aantal valenselektrone in oorgangsmetale te bepaal, vereis sekere beginsels van kwantumteorie wat buite die bestek van hierdie artikel val.
Benodigdhede
- Periodieke Tabel van die Elemente
- Potlood
- Papier
Artikels oor die onderwerp "Bepaling van die aantal valenselektrone"
Оцените, пожалуйста статью
Soortgelyk
Gewilde