In hierdie formule, n die aantal mol, bl die druk, V die volume, t die temperatuur in Kelvin en R die gaskonstante. Voorbeeld: n=PV/RT=(0,984 atm x 1 L) / (0,08206 L atm mol-1 K-1 x 318,15 K)=0,0377 mol 
Voorbeeld: 14,42 g / 0,0377 mol=382,49 g/mol 
Voorbeeld: (12,0107g x 12) + (15,9994g x 1) + (1,00794g x 30)=144,1284 + 15,9994 + 30,2382=190,366g 
Voorbeeld: 382.49 / 190.366=2.009 
Voorbeeld: C12OH30 x 2=C24O2H60 

Voorbeeld: 75,46 g C x (1 mol / 12,0107 g)=6,28 mol C 8,43 g O x (1 mol / 15,9994 g)=0,53 mol O 16,11 g H x (1 mol / 1,00794) = 15,98 mol H 
Voorbeeld: Die kleinste molêre hoeveelheid is suurstof met 0,53 mol. 6,28 mol/0,53 mol=11,83 0.53 mol/0.53 mol=1 15.98 mol/0.53 mol=30.15 
Voorbeeld: die verhoudingsformule word dan C12OH30 11,83=12 1=1 30.15=30 


Bepaling van die molekulêre formule van 'n stof
Inhoud
Die molekulêre formule is `n belangrike stukkie inligting oor `n chemiese stof. Die molekulêre formule dui aan watter atome in die stof teenwoordig is en hoeveel van elk. Jy het die verhoudingsformule nodig om die molekulêre formule te bereken en jy moet ook weet dat die verskil tussen hierdie twee formules `n heelgetal is.
Trappe
Deel 1 van 3: Afleiding van die molekulêre formule van `n verhouding formule

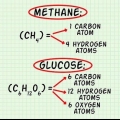
1. Ken die verband tussen die molekulêre formule en die verhoudingsformule. Die verhoudingsformule sê iets oor die verhouding van atome binne `n molekule, byvoorbeeld twee suurstofatome op elke koolstofatoom. Die molekulêre formule vertel jou hoeveel van elk van hierdie atome in die molekule teenwoordig is. Byvoorbeeld, een koolstof- en twee suurstofatome (koolstofdioksied). Hierdie twee formules hou verband met mekaar met `n heelgetal op so `n manier dat as die verhoudingsformule met daardie verhouding vermenigvuldig word, die molekulêre formule uitkom.

2. Bereken die aantal mol gas. Dit beteken dat jy die ideale gaswet gebruik. Jy kan die aantal mol bepaal op grond van die druk, volume en temperatuur soos verskaf deur data van eksperimente. Die aantal mol kan bereken word deur die formule: n=PV/RT.

3. Bereken die molekulêre massa van die gas. Dit kan slegs gedoen word wanneer die aantal mol teenwoordig in die gas bekend is, deur die ideale gaswet te gebruik. Jy sal ook moet weet hoeveel gram van `n gas teenwoordig is. Deel dan die aantal gram gas deur die aantal mol van die gas teenwoordig, om die molekulêre massa te bepaal.

4. Tel die atoommassas van alle atome in die verhoudingsformule bymekaar. Elke atoom in die verhoudingsformule het sy eie atoommassa. Hierdie waarde kan gevind word onderaan daardie element se boks, in die periodieke tabel. Voeg hierdie massas bymekaar om die massa van die verhoudingsformule te kry.

5. Bepaal die verhouding tussen die molekulêre massa en dié van die verhoudingsformule. Dit laat jou toe om te bepaal hoe gereeld die massa in die werklike molekule gaan volgens die verhoudingsformule. As jy dit weet, dan weet jy ook hoeveel keer die verhoudingsformule in die molekulêre formule ingaan. Dit moet `n heelgetal wees. As die verhouding nie `n heelgetal is nie, moet jy dit afrond.

6. Vermenigvuldig die verhoudingsformule met die verhouding. Vermenigvuldig die subskripsies van die verhoudingsformule met die verhouding. Dit sal jou die molekulêre formule gee. Let daarop dat vir enige stof met `n verhouding van `1`, die verhoudingsformule en molekulêre formule dieselfde sal wees.
Deel 2 van 3: Bepaling van die verhoudingsformule

1. Bepaal die massa van elke atoom teenwoordig. Soms sal die massa van elke atoom gegee word. Op `n ander tyd word slegs die massa as `n persentasie gegee. Indien dit die geval is, neem aan dat dit `n 100 g monster van die stof is. Hiermee kan jy die massapersentasie as werklike massa in gram skryf.
- Voorbeeld: 75,46 g C, 8,43 g O, 16,11 g H

2. Skakel die massas om na die aantal mol. Jy moet die molekulêre massa van elke element in mol omskakel. Om dit te doen, deel die molekulêre massa deur die atoommassa van elke onderskeie element. Jy kan die atoommassa onderaan daardie element se boks in die periodieke tabel vind.

3. Deel elke molêre waarde deur die kleinste molêre waarde. Jy moet die mol van elke individuele element deel deur die kleinste molêre hoeveelheid van al die elemente wat in die verbinding teenwoordig is. Dit laat jou toe om die eenvoudigste molverhoudings te bepaal. Dit is geldig omdat die element teenwoordig in die minste hoeveelheid op `1` gestel is, en dit gee die onderskeie proporsies van die ander elemente in die verbinding.

4. Rond die molêre waardes af tot heelgetalle. Hierdie getalle word die subskripsies van die verhoudingsformule. Rond af tot die naaste heelgetal. Nadat jy hierdie getalle bepaal het, kan jy die verhoudingsformule neerskryf.
Deel 3 van 3: Verstaan die chemiese formule

1. Verstaan hoe `n verhoudingsformule werk. `n Verhoudingsformule gee jou inligting oor die verhouding van een atoom tot `n ander in `n molekule. Dit gee jou geen inligting oor hoeveel atome presies in die molekule teenwoordig is nie. Die verhoudingsformule gee jou ook geen inligting oor die struktuur en binding van die atome in `n molekule nie.

2. Weet wat `n molekulêre formule vir jou sê. Soos die verhoudingsformule, gee die molekulêre formule jou nie inligting oor die binding en struktuur van `n molekule nie. Maar anders as die verhoudingsformule, gee die molekulêre formule jou wel inligting oor hoeveel van elke atoom in die molekule teenwoordig is. Die verhoudingsformule en molekulêre formule hou verband met mekaar volgens `n heelgetalverhouding.

3. Verstaan struktuurformules. Struktuurformules verskaf selfs meer inligting as molekulêre formules. Behalwe om die aantal atome in `n molekule te noem, gee struktuurformules jou ook inligting oor die bindings en struktuur van die molekule. Hierdie inligting is van kardinale belang om te verstaan hoe die molekule sal reageer.
Wenke
- Lees die stelling (of data) aandagtig deur.
Waarskuwings
- Moenie die verhoudingsformule en die molekulêre formule verwar nie.
Benodigdhede
- Periodieke Tabel van die Elemente
- Sakrekenaar
- Potlood
- Papier
Artikels oor die onderwerp "Bepaling van die molekulêre formule van 'n stof"
Оцените, пожалуйста статью
Soortgelyk
Gewilde