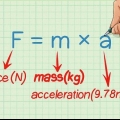In die voorbeeld hierbo, veronderstel jy sit waterstof en suurstof in die kalorimeter, verseël dit en let op `n temperatuur (T1) van 150K (wat baie laag is). 

In die voorbeeld, veronderstel die tweede temperatuur is (T2) of 95K. 
In die voorbeeld bereken jy ∆T soos volg:
∆T = T2 – T1 = 95K – 185K = -90K 
In die voorbeeld hierbo gebruik jy waterstof en suurstof, wat molêre massas van onderskeidelik 2g en 32g het. Aangesien jy 2 mol waterstof het en 1 mol suurstof gebruik het, kan jy die totale massa van die reaktante soos volg bereken:
2x(2g) + 1x(32g) = 4g + 32g = 36g 
In die formule is m die totale massa van die reaktante; s is die spesifieke hitte, wat ook konstant is vir enige element of verbinding. In die voorbeeld hierbo is die finale produk water, met `n spesifieke hitte van 4,2 JK-1 g-1. Die entalpie van die reaksie kan dus soos volg bereken word:
∆H=(36g) x (4.2 JK-1 g-1) x (-90K )=-13608 J 
In die voorbeeld hierbo is die laaste antwoord -13608 J. Dit is dus `n eksotermiese reaksie wat `n aansienlike hoeveelheid energie gebruik.
Bepaling van die entalpie van 'n reaksie
Wanneer jy chemiese komponente meng, hetsy in die kombuis of in `n chemiese laboratorium, skep jy nuwe stowwe, wat ons "produkte" noem. Tydens hierdie chemiese reaksies kan hitte geabsorbeer word uit of vrygestel word in die omgewing. Die uitruil van hitte tydens `n chemiese reaksie met die omgewing staan bekend as die entalpie van `n reaksie, geskryf as ∆H. Lees die volgende artikel om ∆H te vind.
Trappe

1. Berei die reaktante voor vir die chemiese reaksie. Om die entalpie van `n reaksie korrek te meet, moet jy eers die korrekte hoeveelheid van elke reaktant hê.
- Gestel byvoorbeeld jy wil die entalpie vind van die reaksie waarin water uit waterstof en suurstof gevorm word: 2H2 (Waterstof) + O2 (Suurstof)→2H2O (Water). Kom ons neem vir die doel van hierdie voorbeeld aan ons het 2 mol waterstof en 1 mol suurstof.

2. Maak die reaksiehouer skoon. Om te verseker dat die reaksie sonder kontaminasie plaasvind, maak die reaksiehouer skoon (gewoonlik `n kalorimeter) wat jy van plan is om te gebruik.

3. Plaas `n roerstok en `n termometer in die reaksiehouer. Berei die mengsel voor soos nodig en meet hul temperatuur deur beide die roerstok en die termometer in dekalorimeter te hou.

4. Gooi die reaktante in die reaksiehouer. Sodra alles goed voorberei is, kan jy die reaktante in die kalorimeter sit. Maak dit onmiddellik daarna toe.

5. Meet die temperatuur. Gebruik die termometer wat in die kalorimeter geplaas is, teken die temperatuur onmiddellik aan nadat die reaktante bygevoeg is.

6. Gaan voort met die kommentaar. Gee die stowwe tyd om te reageer, roer indien nodig om dit presies te versnel.

7. Meet weer die temperatuur. Wanneer die reaksie klaar is, teken die temperatuur weer aan.

8. Bereken die verskil in temperatuur van T1 en T. Jy skryf die verskil as ∆T.
∆T = T2 – T1 = 95K – 185K = -90K

9. Bepaal die totale massa van die reaktante. As jy die totale massa van die reaktante wil bereken, benodig jy die molêre massa van jou komponente. Molêre massa is `n konstante; jy kan dit in standaard periodieke tabelle of ander chemietabelle vind.
2x(2g) + 1x(32g) = 4g + 32g = 36g

10. Bereken die entalpie van die reaksie. Sodra jy dit gedoen het, kan jy die entalpie van die reaksie bepaal. Die formule lyk soos volg: ∆H = (m) x (s) x ( ∆T)
∆H=(36g) x (4.2 JK-1 g-1) x (-90K )=-13608 J

11. Maak `n aantekening van die resultaat. As die teken van jou antwoord negatief is, dan is die reaksie eksotermies: hitte gaan verlore aan die omgewing. As die teken van die antwoord positief is, dan is die reaksie endotermies: hitte word uit die omgewing geabsorbeer.
Wenke
- Hierdie berekeninge word in Kelvin (K) gedoen – `n temperatuurmetingskaal net soos Celsius. As jy Kelvin na Celsius wil omskakel, voeg net 273 grade by: K = C + 273.
Artikels oor die onderwerp "Bepaling van die entalpie van 'n reaksie"
Оцените, пожалуйста статью
Soortgelyk
Gewilde