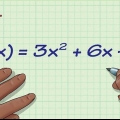Nul beteken dat die konsentrasie vir daardie reaktant nie die reaksietempo beïnvloed nie. Een beteken dat die verhoging van die konsentrasie van hierdie reaktant die reaksietempo lineêr sal verhoog (verdubbeling van die reaktant verdubbel die tempo van die reaktant). Twee beteken die tempo van die reaksie sal toeneem met die kwadraat van die verhoogde konsentrasie (verdubbeling van die reaktant sal die tempo met vier keer verhoog). Nul-reaktors word dikwels nie in die tempovergelyking gelys nie, want enige getal wat tot die nulkrag verhoog word, is gelyk aan een. 
Gestel byvoorbeeld die eerste reaktant is eerste orde (het `n eksponent van 1) en reaktant twee is eerste orde (ook eksponent 1), dan is die algemene reaksie een van tweede orde. 







Bepaling van die volgorde van 'n reaksie
Inhoud
Om te weet hoe verskillende konsentrasies chemikalieë die tempo van `n reaksie beïnvloed, is noodsaaklik vir baie chemiese prosesse. Die term "reaksieorde" (of volgorde van reaksie) verwys na hoe die konsentrasie van een of meer reaktante (chemikalieë) die tempo van die reaksie beïnvloed. Die finale volgorde van `n reaksie is die som van die volgorde van alle reaktante teenwoordig. Terwyl kyk na `n ewewigsvergelyking jou nie sal help om die volgorde van die reaksie te bepaal nie, kan jy hierdie inligting kry deur na die tempovergelyking te kyk of deur die betrokke reaksie te teken.
Trappe
Metode 1 van 3: Ontleed die spoedvergelyking

1. Bepaal die tempovergelyking van die reaksie. Die tempovergelyking kan jou help om die volgorde van die reaksie te bepaal. Hierdie vergelyking toon die toename of afname van `n gegewe stof oor tyd. Ander vergelykings wat met die chemiese reaksie verband hou, sal jou nie help om die volgorde van die reaksie te bepaal nie.

2. Kontroleer die volgorde van elke reaktant. Elke reaktant in die tempovergelyking sal `n eksponent van 0, 1 of 2 hê (bo 2 is baie skaars). Daardie eksponent dui die volgorde van daardie reaktant aan. Ons kyk na elke eksponent:

3. Voeg die volgorde vir alle reaktante bymekaar. Die totale volgorde van `n reaksie is die som van die volgorde van alle reaktante. Voeg die eksponente van elke reaktant bymekaar om die algemene volgorde van die reaksie te bepaal. Hierdie getal is gewoonlik minder as of gelyk aan twee.
Metode 2 van 3: Vertoon datapunte as `n grafiek

1. Vind die veranderlikes wat `n lineêre grafiek van die reaksie maak. `n Lineêre grafiek verwys na `n grafiek wat `n konstante tempo van verandering het. Met ander woorde, die afhanklike veranderlike sal in die eerste sekonde soveel verander as die tweede, derde, ensovoorts. `n Lineêre grafiek lyk soos `n reguit lyn.

2. Stip die konsentrasie van die reaktant teen tyd. Dit dui aan hoeveel reaktant op `n gegewe punt tydens die reaksie oor is. As hierdie grafiek lineêr is, beteken dit dat die konsentrasie van die reaktant nie die tempo waarteen die reaksie verloop, beïnvloed nie. In hierdie geval is die reaktant van orde nul.

3. Gee die natuurlike logaritme van die konsentrasie van die reaktant teenoor tyd. As die natuurlike logaritme van die reaktant `n lineêre grafiek tot gevolg het, is die reaktant een van eerste orde. Dit beteken dat die konsentrasie van die reaktant die reaksietempo beïnvloed. As die grafiek nie lineêr is nie, moet jy die grafiek vir `n tweede-orde reaksie toets.

4. Teken [1/konsentrasie van reaktant] teen tyd. `n Lineêre grafiek van [1/konsentrasie van reaktant] dui `n tweede-orde reaksie aan. Dit beteken dat die tempo van die reaksie sal toeneem met die kwadraat van enige toename in reaktant. As hierdie grafiek nie lineêr is nie, moet jy probeer om die nul- en eerste-orde reaksies te teken.

5. Vind die som van die volgorde vir alle reaktante. Sodra jy `n lineêre grafiek vir elke reaktant gevind het, weet jy ook die volgorde van elke reaktant. Laat jou toe om die gevolglike volgorde van die reaksie te bereken. Tel al die reaktiewe rye by. Dit is dan die reaksievolgorde van die hele reaksie.
Metode 3 van 3: Los gevallestudies op

1. Bepaal die volgorde van `n reaksie wanneer verdubbeling van een van die reaktante `n verdubbeling van die tempo tot gevolg het. As verdubbeling van die konsentrasie van `n reaktant veroorsaak dat die tempo verdubbel, dan is daardie reaktant eerste orde. In hierdie geval is beide reaktante van die eerste orde. Die som van twee eerste orde reaktante is `n tweede orde reaksie.

2. Vind die volgorde van `n reaksie waarin verdubbeling van beide reaktante nie die tempo verander nie. As die verandering van die konsentrasie van `n reaktant nie `n verandering in sy tempo veroorsaak nie, is daardie reaktant nul-orde. In hierdie geval is beide reaktante nul-orde. Die som van twee nul-orde is `n algemene nul-orde reaksieorde.

3. Bepaal die volgorde van `n reaksie waar verdubbeling van een reaktant die tempo vervierdubbel. Die reaktant wat die reaksietempo beïnvloed is tweede orde. Die tweede reaktant beïnvloed nie die tempo nie en is van nul orde. Die som van die ordes is twee, so dit is `n tweede orde reaksie.
Artikels oor die onderwerp "Bepaling van die volgorde van 'n reaksie"
Оцените, пожалуйста статью
Soortgelyk
Gewilde