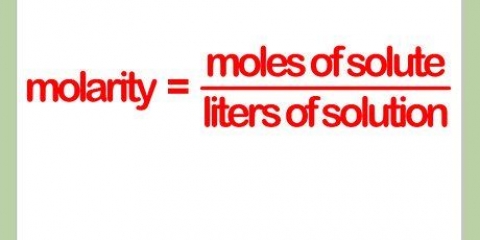Baie chemikalieë kom in `n opgeloste, vloeibare vorm, eerder as `n vaste vorm. Vloeistowwe is makliker om te doseer en te meet as vaste stowwe, veral aangesien die vaste vorm gewoonlik `n poeier is. Die stoïgiometrie van chemiese reaksies word egter bemoeilik deur die vloeistofafleweringsmetode. Stoïgiometrie is gebaseer op berekeninge met behulp van die hoeveelheid van die verlangde stof, wat in die vergelykings geplaas word. Die vloeistof wat gebruik word om die stof op te los, sal nie aan die reaksie deelneem nie en stoïgiometrie sal nie daardie vloeistof in die reaksie insluit nie. Die hoeveelheid van die stof betrokke by die reaksie kan bepaal word deur die normaliteit van die oplossing te vind. Gebruik hierdie wenke om te leer om normaliteit te bereken.
Trappe
1. Versamel inligting oor die ekwivalente gewig van die reagerende stof. Raadpleeg die chemiese naslaanboeke om die valensie en molekulêre gewig van die stof uit te vind. Molekulêre gewig is die verhouding van die massa van 1 molekule van die stof tot sy massa (`n koolstof-12 molekule gedeel deur 12). Valensie word bepaal deur die maksimum aantal subatomiese valensies of atoombindings wat `n stof met ander stowwe kan vorm. Hierdie inligting is nodig om normaliteit te bepaal.
2. Bereken die ekwivalente gewig van die stof. Die ekwivalente gewig van die stof is gelyk aan die molekulêre gewig gedeel deur die valensie.
3. Bereken normaliteit. Normaliteit is die konsentrasie van die stof van belang in `n oplosbare vloeistof. Daarom is normaliteit `n eienskap van die mengsel, en sal wissel na gelang van die hoeveelheid vloeistof wat gebruik word om die oplossing te maak. Normaliteit is die gram van die betrokke stof, gedeel deur die totaal van die oplossing (die ekwivalente gewig van die stof keer die hoeveelheid van die oplossing vloeistof).
4. N voorbeeld: Los natriumchloried (NaCl) op in water. Natriumchloried het `n valensie van 1 en `n molekulêre gewig van 58,443. Die ekwivalente gewig is dus 58.443/1 = 58.443. 1 gram NaCl word in 0,05 l water opgelos, dus is die normaliteit van die oplossing 1/(58,443 x 0,05) = 0,342.
Artikels oor die onderwerp "Normaliteit te bereken"