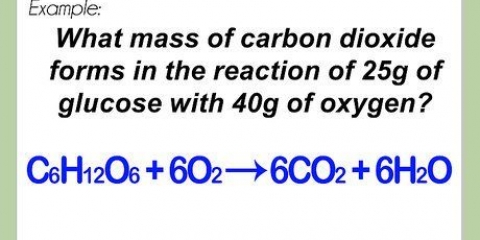Voorbeeld opdrag: Mol = 0,75 mol NaCl Volume = 4,2 L 
Voorbeeld probleem: molariteit = 0,75 mol / 4.2L = 0,17857142 
Voorbeeld opdrag: 0,179 M NaCl 

Voorbeeld opdrag: Massa = 3,4 g KMnO4 Volume = 5,2 L 
Voorbeeld opdrag: Die molêre massa van K = 39,1 g Die molêre massa van Mn = 54,9 g Die molêre massa van O = 16.0 g Totale molêre massa = K + Mn + O + O + O + O = 39,1 + 54.9 + 16 + 16 + 16 + 16 = 158,0 gram 
Voorbeeld probleem: gram stof * (1/molêre massa van die stof) = 3,4 g * (1 mol / 158 g) = 0,0215 mol 
Voorbeeld probleem: molariteit = 0,0215 mol / 5.2L = 0.004134615 
Voorbeeld opdrag: 0,004 M KMnO4 

Voorbeeld opdrag: Aantal mol = 1,2 mol CaCl2 Volume = 2905 ml 
Voorbeeldstelling: 2905 ml * (1 L / 1000 ml) = 2905 L 
Voorbeeldopdrag: 1.2 mol CaCl2 / 2905L = 0,413080895 
Voorbeeld opdrag: 0,413 M CaCl2 

Die molêre massa van Na = 22,99 g Die molêre massa van Cl = 35,45 g Die molêre massa van NaCl = 22,99 + 35.45 = 58,44 gram 
Mol NaCl = 5,2 g NaCl * (1 mol / 58,44 g) = 0,08898 mol = 0,09 mol 
Jy kan dit ook sien as die vermenigvuldiging van 800 ml met `n omskakelingsfaktor van 1 L / 1000 ml. Om dit vinnig te doen, al wat jy hoef te doen is om die desimale punt 3 syfers na links te skuif, in plaas daarvan om dit te bereken. Volume = 800 ml * (1 L / 1000 ml) = 800 ml / 1000 ml = 0,8 L 
Molariteit = aantal mol stof / aantal liter oplossing = 0,09 mol / 0,8 L = 0,1125 mol/L 
Antwoord: 0,11 M NaCl
Bereken die molariteit van 'n oplossing
Inhoud
Molariteit is `n beskrywing van die verband tussen die aantal mol van `n vloeistof en sy volume. Om molariteit te bereken, begin jy met mol en volume, massa en volume of mol en milliliter. Hierdie veranderlikes word dan in die standaard molariteit berekeningsformule ingevul om (hopelik) die korrekte antwoord te kry.
Trappe
Metode 1 van 4: Bereken molariteit deur mol en volume te gebruik

1. Leer die standaardformule vir die berekening van molariteit. Molariteit is gelyk aan die aantal mol van `n opgeloste stof gedeel deur die volume van die oplossing in liter. Dit is reeds geskryf: molariteit = aantal mol stof / aantal liters oplossing
- Voorbeeldopdrag: Wat is die molariteit van `n oplossing van 0,75 mol NaCl in 4,2 liter water?

2. Kyk na die opdrag. Die berekening van molariteit vereis `n sekere aantal mol stof en aantal liters oplossing. As die staat voorsiening maak vir hierdie syfers, hoef geen voorbereidingswerk gedoen te word nie.

3. Deel die aantal mol deur die aantal liters. Die breuk wat jy dan kry gee die aantal mol per liter oplossing, ook bekend as die molariteit.

4. Skryf jou antwoord. Voltooi die antwoord korrek, afhangend van jou metingsdata en die vereistes van die probleem. Kort die woord "molariteit" af met "m" en gebruik die chemiese naam van die opgeloste stof.
Metode 2 van 4: Bereken molariteit met massa en volume

1. Jy ken die standaardformule vir die berekening van molariteit.molariteit = aantal mol stof / aantal liters oplossing
- Voorbeeldprobleem: Wat is die molariteit van `n oplossing deur 3,4 g KMnO op te los4 in 5,2 liter of water?

2. Kyk na die opdrag. Die berekening van molariteit vereis `n sekere aantal mol stof en aantal liters oplossing. As die staat nie hierdie syfers verskaf nie, moet `n paar voorlopige werk gedoen word voordat jy kan voortgaan.

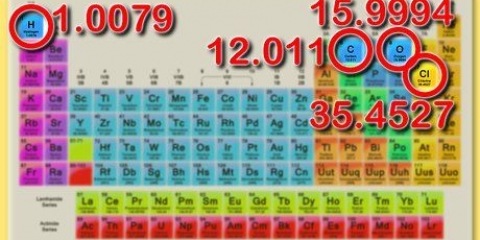
3. Bepaal die molêre massa van die opgeloste stof. Om die mol van die opgeloste stof te vind, is dit nodig om eers die molêre massa te bereken. Jy doen dit deur die verskillende molêre massas van elke element van die stof bymekaar te tel. Hierdie molêre massa kan gevind word deur die periodieke tabel te gebruik.

4. Skakel gram om na mol. Noudat jy die molêre massa van die opgeloste stof ken, is dit steeds nodig om dit om te skakel na die aantal mol. Jy doen dit deur te bepaal wat 1 mol van die stof weeg en dit dan met die molêre massa te vermenigvuldig.

5. Deel die aantal mol deur die aantal liter oplossing om die molariteit te vind.

6. Skryf jou antwoord. Voltooi die antwoord korrek, afhangend van jou metingsdata en die vereistes van die probleem. Kort die woord "molariteit" af met "m" en gebruik die chemiese naam van die opgeloste stof.
Metode 3 van 4: Bereken molariteit deur mol en milliliter te gebruik

1. Jy ken die standaardformule vir die berekening van molariteit.molariteit = aantal mol stof / aantal liters oplossing. As die volume in milliliter gegee word, sal jy dit moet omskakel.
- Voorbeeldprobleem: Wat is die molariteit van `n oplossing van 1,2 mol CaCl2 in 2905 milliliter water?

2. Kyk na die opdrag. Die berekening van molariteit vereis `n sekere aantal mol stof en aantal liters oplossing. As die staat nie hierdie syfers verskaf nie, moet `n paar voorlopige werk gedoen word voordat jy kan voortgaan.

3. Skakel die aantal milliliter om na liter. Vind die aantal liters van die oplossing deur die volume deur 1000 te deel, of skuif die desimale punt 3 syfers na links.

4. Deel die aantal mol deur die aantal liters. Noudat jy al die getalle in `n ry het, kan jy die molariteit van die oplossing bereken.

5. Skryf jou antwoord. Voltooi die antwoord korrek, afhangend van jou metingsdata en die vereistes van die probleem. Kort die woord "molariteit" af met "m" en gebruik die chemiese naam van die opgeloste stof.
Metode 4 van 4: Ekstra oefenprobleem

1. Ons wil die molariteit van `n oplossing van 5,2 g NaCl in 800 ml water bepaal. Lys eers hierdie waardes vir duidelikheid: massa in gram en volume in milliliter.
- Massa = 5,2 g NaCl
- Volume = 800ml water

2. Bepaal die molêre massa van NaCl. Jy doen dit deur die molêre massa van natrium (Na) en die molêre massa van chloor (Cl) by te voeg.

3. Vermenigvuldig die massa van die stof met die omskakelingsfaktor van die molêre massa. In hierdie voorbeeld is die molêre massa van NaCl 58.44 g, so jy het 1 mol / 58,44 g.

4. Deel 800 ml water deur 1000 om die aantal liter te kry.

5. Verdeel die mol van `n stof deur die liters van die oplossing. Om die molariteit te vind, verdeel 0,09 mol van die stof NaCl deur 0,8 L van die oplossing.

6. Maak jou antwoord netjieser. Rond jou antwoord af tot twee of drie desimale plekke en verkort molariteit tot “M.”
Artikels oor die onderwerp "Bereken die molariteit van 'n oplossing"
Оцените, пожалуйста статью
Gewilde