Gebruik die term `aflees `n groep` om van bo na onder te lees. Die nommering word gewoonlik bo die kolomme aangedui; dit kan egter ook onder ander groepe val, soos die metale. Die nommering wat in die periodieke tabel gebruik word, verskil baie. Hulle kan Romeins (IA), Arabies (1A) of die getalle 1 tot 18 wees. Waterstof kan in die halogeenfamilie en die alkalimetale wees, of albei. 
Periodes word gewoonlik van 1 tot 7 aan die linkerkant van die tabel genommer. Elke tydperk is groter as die vorige een. Dit hou verband met die verhoging van die energievlakke van die atome in die periodieke tabel. 
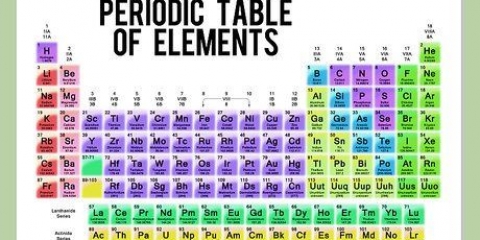
Die groep Metals het een kleur. Waterstof het egter dikwels dieselfde kleur en groep as die nie-metale. Metale het glans, is gewoonlik solied by kamertemperatuur, gelei hitte en elektrisiteit, en is smeebaar en smeebaar. Nie-metale het dieselfde kleur. Dit is die elemente C-6 tot Rn-86, insluitend H-1 (waterstof). Hulle het geen glans nie, gelei hitte en elektrisiteit en is nie smeebaar nie. Hulle vorm gewoonlik `n gas by kamertemperatuur en kan `n vaste stof, gas of vloeistof wees. Halfmetale/metalloïede het gewoonlik `n pers of groen kleur, as `n kombinasie van die ander twee kleure. Die lyn is diagonaal en strek van elemente B-5 tot At-85. Hulle het sekere eienskappe van metale en sommige van nie-metale. 
Die nommering kan Romeinse, Arabiese of standaardgetalle wees. 





Neem asseblief kennis dat daar `n uitsondering op hierdie reël is. As die atoom elektrone verloor of bykry, word dit `n elektries gelaaide ioon. As daar `n plusteken langs die element se simbool is, dui dit aan dat dit positief gelaai is. Met `n minus simbool is dit negatief gelaai. As dit nie `n plus- of minus-simbool het nie, en jou chemieprobleem gaan nie oor ione nie, dan is die aantal protone en elektrone waarskynlik gelyk. 


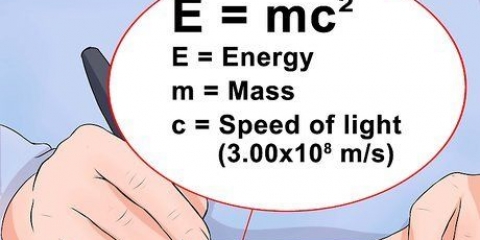
Byvoorbeeld: Die atoommassa van yster is 55,847, dus is die massagetal 56. Die element het 26 protone. 56 (massagetal) minus 26 (protone) is 30. Daar is gewoonlik 30 neutrone in `n enkele ysteratoom. Die verandering van die aantal neutrone in `n atoom vorm isotope, wat swaarder of ligter weergawes van die atoom is.
Verstaan die periodieke tabel van die elemente
Inhoud
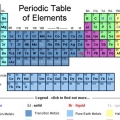
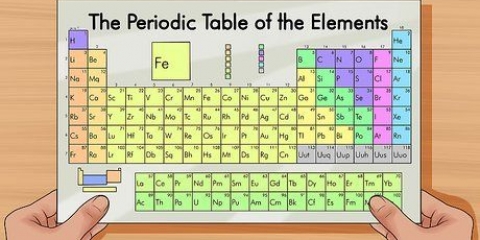
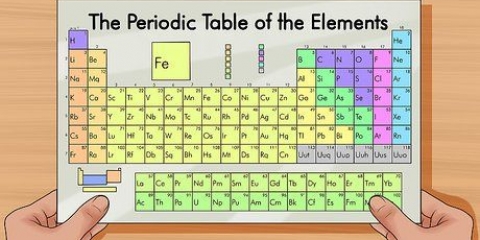
Die periodieke tabel van elemente is `n lys van die 118 elemente wat tot dusver ontdek is. Daar is verskeie simbole en nommers wat die verskille in die elemente aandui, terwyl die struktuur van die tabel die elemente volgens ooreenkomste organiseer. Jy kan die periodieke tabel lees deur die riglyne hieronder te gebruik.
Trappe
Deel 1 van 4: Verstaan die struktuur

1. Dink aan die periodieke tabel as begin bo links en eindig aan die einde van die laaste ry, onder en regs. Die tabel is van links na regs gestruktureer in volgorde van toenemende atoomgetal. Die atoomgetal is die aantal protone in `n enkele atoom.
- Nie elke ry of kolom is voltooi nie. Alhoewel daar gapings in die middel kan wees, hou aan om die tabel van links na regs te lees. Byvoorbeeld, waterstof het atoomnommer 1 en is in die boonste linkerhoek. Helium het atoomnommer 2 en is in die regter boonste hoek geleë.
- Elemente 57 tot 71 word gewoonlik as `n subset in die onderste regterhoek van die tabel uitgebeeld. Dit is die `skaars aarde elemente`.

2. In elke kolom van die tabel sal jy `n `groep` elemente vind. Daar is 18 kolomme.

3. In elke ry van die tabel sal jy die `periodes` van die elemente vind. Daar is 7 periodes. Gebruik die uitdrukking `lees langs `n punt` om van links na regs te lees.

4. Verstaan die bykomende groepe tot metaal, halfmetaal en nie-metaal. Die kleure verskil baie.

5. Weet dat die elemente soms ook in gesinne aangedui word. Dit is die alkalimetale (1A), aardalkalimetale (2A), halogene (7A), edelgasse (8A) en koolstofatome (4A).
Deel 2 van 4: Verstaan die simbool en benaming

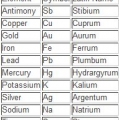
1. Lees eers die simbool. Dit bestaan uit een of twee letters en is standaard in verskeie tale.
- Die simbool kan afgelei word van die Latynse naam van die element of die algemene algemene naam.
- In baie gevalle volg die simbool die Engelse naamkonvensie, soos Helium, oftewel `He`. Dit is egter nie `n reël wat jy kan aanneem nie. Byvoorbeeld, yster is `Fe`. Om hierdie rede word die simbool/naam kombinasie gewoonlik onthou vir vinnige verwysing.

2. Kyk na die algemene naam. Dit is direk onder die simbool. Dit verskil na gelang van die taal waarin die periodieke tabel geskryf is.
Deel 3 van 4: Lees die atoomgetal

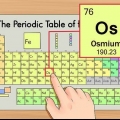
1. Lees die periodieke tabel volgens die atoomgetal in die boonste middel van die boks van elke element. Soos voorheen genoem, word die stelsel van links bo na regs onder gerangskik. Om die atoomgetal te ken, is die vinnigste manier om meer inligting oor die element op te soek.

2. Die atoomgetal is die aantal protone in die kern van `n enkele atoom van die element.

3. Die byvoeging of verwydering van protone skep `n ander element.

4. Om die aantal protone in `n atoom uit te vind, is ook die bepaling van die aantal elektrone. Atome het dieselfde aantal elektrone as protone.
Deel 4 van 4: Lees die atoommassa

1. Bepaal die atoommassa. Dit is die nommer onder die element se algemene naam.
- Alhoewel dit mag lyk asof die atoommassa toeneem van links bo van die sisteem na regs onder, is dit nie in alle gevalle waar nie.

2. Verstaan dat die meeste elemente met desimale vertoon word. Die atoommassa is die totaal van die deeltjies in die kern; dit is egter `n geweegde gemiddelde van die verskillende isotope.

3. Gebruik die atoommassa om die aantal neutrone in `n enkele atoom te vind. Rond die atoommassa af tot die naaste heelgetal, die massagetal. Dan trek jy die aantal protone van die massagetal af om die aantal neutrone te vind.
Artikels oor die onderwerp "Verstaan die periodieke tabel van die elemente"
Оцените, пожалуйста статью
Gewilde