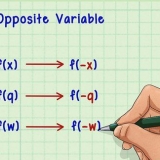
As dit `n desimale is, kyk jy waarskynlik na die atoommassa. 
Daar kan `n leë spasie wees na die elemente 56 (barium) en 88 (radium). Daar is nie eintlik `n spasie nie; die elemente met die atoomgetalle wat daar hoort is in twee rye onder die res van die sisteem. Die enigste rede waarom hulle so geskei word, is om die periodieke tabel minder breed te maak. 
Om dit anders te stel, enige atoom met agt protone is `n suurstofatoom. Twee suurstofatome kan `n verskillende aantal neutrone hê of (as een `n ioon is) `n verskillende aantal elektrone, maar hulle sal albei altyd agt protone hê. 

In die praktyk word die atoommassa gewoonlik reeds gegee vir chemieprobleme wat net oor een atoom handel. Verstaan hierdie konsep om nie verbaas te wees as dit van die atoomgewig verskil nie. 
Dit werk omdat neutrone en protone albei naby 1 AMU is en elektrone naby 0 AMU is. Vir die atoomgewig word presiese metings gebruik om die desimale getal te verkry, maar ons stel net belang in die heelgetalle wat vir ons die aantal protone en neutrone vertel. Onthou dat as jy die atoomgewig gebruik, jy `n gemiddelde kry vir `n tipiese monster. `n Broommonster het `n massagetal van ongeveer 80, maar soos dit blyk, het `n enkele broomatoom byna altyd `n massagetal van 79 of 81. 
`n Enkele heliumatoom (He) het `n massagetal van 4 en `n atoomgetal van 2. Daarom moet dit 4 - 2 = wees 2 neutrone om te hê. `n Monster silwer (Ag) het `n massagetal van ongeveer 108 (volgens die periodieke tabel) en `n atoomgetal van 47. Gemiddeld het elke silwer atoom in die monster 108 - 47 = 61 neutrone. 
Isotope het nie `n ander atoomgetal nie. Elke isotoop van `n element het dieselfde aantal protone.
Bepaal die atoomgetal van 'n element
Die atoomgetal van `n element is die aantal protone in die kern van `n enkele atoom van daardie element. Die atoomgetal van `n element of isotoop verander nie, dus kan jy die atoomgetal gebruik om ander kenmerke van `n element of isotoop te bereken, soos die aantal neutrone.
Trappe
Deel 1 van 2: Vind die atoomgetal

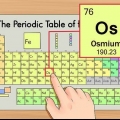
1. Soek `n kopie van die periodieke tabel. Jy kan een hier vind as jy nie een byderhand het nie. Elke element het `n ander atoomgetal, so daar is geen vinnige en maklike metodes om toe te pas nie. Jy sal óf `n kopie van die periodieke tabel óf een moet vind uit die kop moet leer.
- Die meeste chemieboeke het `n periodieke tabel op die binneblad gedruk.

2. Vind die element wat jy bestudeer. Die meeste periodieke tabelle bevat die volle name van die verskillende elemente, sowel as hul chemiese simbole (soos Hg vir kwik). As jy probleme ondervind om die element te vind, moet jy aanlyn soek vir `chemiese simbool` gevolg deur die naam van die element.

3. Vind die atoomgetal. Die atoomgetal is gewoonlik in die boonste linker- of regterhoek van die boks waarin die element is, maar dit kan ook iewers anders in die boks wees. Die atoomgetal is altyd `n heelgetal.

4. Verifieer teen naburige elemente. Die periodieke tabel word volgens atoomgetal gerangskik. As jou element se atoomgetal `33` is, moet die element aan die linkerkant `32` wees en die element aan die regterkant moet `34` wees. As hierdie volgorde korrek is, het jy beslis die atoomgetal gevind.

5. Verstaan wat die atoomgetal is. Daar is `n eenvoudige definisie vir die atoomgetal van `n element: die aantal protone in een atoom van daardie element. Dit is die basiese definisie van `n element. Die aantal protone bepaal die totale elektriese lading van die kern, wat bepaal hoeveel elektrone `n atoom kan hê. Aangesien elektrone verantwoordelik is vir byna alle chemiese reaksies, bepaal die atoomgetal indirek byna alle fisiese en chemiese eienskappe van `n element.
Deel 2 van 2: Soek verwante inligting

1. Vind die atoomgewig. Die atoomgewig word gewoonlik onder die naam van die betrokke element in die periodieke tabel gedruk en word gewoonlik tot twee of drie desimale plekke bereken. Dit is die gemiddelde massa van een atoom van die element, aangepas om te pas by wat jy waarskynlik in die natuur teëkom. Hierdie getal is in "atomic mass units" (AMU (van die Engelse "atomic mass unit")).
- Sommige wetenskaplikes gebruik die term "relatiewe atoommassa" in plaas van "atoomgewig".

2. Verstaan wat die atoommassa is. Atoommassa is `n konsep wat baie soortgelyk is aan dié van atoomgewig. Die enigste verskil is dat jy praat van `n spesifieke atoom in plaas van die gemiddelde van `n monster. `n Gram yster bevat baie atome met massas wat effens van mekaar verskil, so jy soek die `relatiewe gewig` om die gemiddelde te vind. As jy net in een spesifieke ysteratoom belangstel, maak die gemiddelde nie vir jou saak nie—jy stel net belang in die presiese massa van daardie spesifieke atoom.

3. Rond af tot massagetal. Die massagetal is die totale aantal protone plus neutrone in een atoom van `n element. Jy kan hierdie getal maklik vind: neem net die atoomgewig wat in die periodieke tabel gegee word en rond af tot die naaste heelgetal.

4. Bereken die aantal neutrone. Jy weet nou dat die atoomgetal = aantal protone, en dat die massagetal = aantal protone + aantal neutrone. Om uit te vind hoeveel neutrone daar in `n element is, moet jy die atoomgetal van die massagetal aftrek. Hier is `n paar voorbeelde:

5. Verstaan wat isotope is. `n Isotoop is `n spesifieke vorm van `n element met `n sekere aantal neutrone. Wanneer `n chemievraag oor "boor-10" of "B" praat, praat hulle van die element boor met `n massagetal van 10. Gebruik hierdie massagetal in plaas van die waarde vir `tipiese` boor.
Wenke
- Sommige swaarder elemente het atoomgewigte wat tussen hakies of hakies ingesluit word. Dit beteken dat die atoomgewig die presiese massa van die mees stabiele isotoop is, eerder as die gemiddelde van veelvuldige isotope. (Dit het geen effek op die element se atoomgetal nie.)
Artikels oor die onderwerp "Bepaal die atoomgetal van 'n element"
Оцените, пожалуйста статью
Gewilde