Byvoorbeeld: `n Natriumatoom met `n lading van -1 het dan een ekstra elektron bygevoeg tot die atoomgetal van 11. Hierdie natriumatoom het dus 12 elektrone in totaal. Die s orbitaal (enige getal in die elektronkonfigurasie gevolg deur a "s") bevat `n enkele orbitaal, en as gevolg van die Pauli . se uitsluitingsbeginsel ons weet dat `n enkele orbitaal `n maksimum van 2 elektrone kan hou, dus kan enige orbitaalvorm 2 elektrone hou. Die p-orbitaal bevat 3 orbitale, kan dus `n totaal van 6 elektrone hou. Die d-orbitaal bevat 5 orbitale, dus kan dit 10 elektrone hou. Die f-orbitaal bevat 7 orbitale, dus kan dit 14 elektrone hou. Byvoorbeeld, `n eenvoudige elektronkonfigurasie: 1s 2s 2p. Hierdie konfigurasie dui aan dat daar twee elektrone in die 1s-orbitaalvorm is, twee elektrone in die 2s-orbitaalvorm en ses elektrone in die 2p-orbitaalvorm. 2 + 2 + 6 = 10 elektrone in totaal. Dit is die elektronkonfigurasie van `n ongelaaide neon-atoom (Ne; atoomnommer 10.) `n Elektronkonfigurasie van `n atoom waarin elke orbitaal heeltemal gevul is, word soos volg geskryf: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p Let daarop dat in die lys hierbo, as alle skulpe gevul is, dit die elektronkonfigurasie van ununoctium (Uuo; atoomnommer 118), die hoogste getal in die periodieke tabel is - dus bevat hierdie elektronkonfigurasie elke nou bekende elektronskulp in `n ongelaaide atoom. Vul die orbitale met elektrone in die volgorde hierbo totdat jy twintig bereik. Die 1s-orbitaal kry twee elektrone, die 2s kry twee, die 2p kry ses, die 3s kry twee, die 3p kry 6, en die 4s kry 2 (2 + 2 + 6 +2 +6 + 2 = 20.) Dus, die elektronkonfigurasie vir kalsium is: 1s 2s 2p 3s 3p 4s. Let wel: Energievlakke verander namate jy opklim. Byvoorbeeld, as jy op die punt is om aan te beweeg na die 4de energievlak, sal dit 4s eerste wees, daarna 3d. Na die vierde vlak gaan jy voort met die vyfde vlak, waar die normale volgorde hervat word. Dit gebeur eers na die 3de energievlak. Die twee kolomme heel links is `n voorstelling van atome waarvan die elektronkonfigurasies eindig in s orbitale, die regterblok van hierdie tabel is `n voorstelling van atome wie se konfigurasies eindig in p orbitale, die sentrale deel, die atome wat eindig in `n d orbitaal, en die onderste gebied, atome wat eindig in f orbitale. Byvoorbeeld, wanneer jy `n elektronkonfigurasie vir chloor (Cl) neerskryf, oorweeg: "Hierdie atoom is in die derde ry (of "periode van tyd") van die periodieke tabel. Dit is ook in die vyfde kolom van die groep p-orbitale. So hierdie elektronkonfigurasie eindig in ...3p Let wel - die groepe d- en f-orbitale in die tabel stem ooreen met energievlakke wat verskil van die tydperk waarin hulle geleë is. Byvoorbeeld, die eerste ry van die groep d orbitale stem ooreen met die 3d orbitaal selfs al is dit in periode 4, terwyl die eerste ry van die f orbitale ooreenstem met die 4f orbitaal al is dit in die sesde periode. Om hierdie konsep goed te verstaan, is dit nuttig om `n voorbeeld van `n konfigurasie neer te skryf. Kom ons skryf die konfigurasie van sink (atoomgetal 30) deur die verkorte notasie vir `n edelgas te gebruik. Die volledige elektronkonfigurasie van sink is: 1s 2s 2p 3s 3p 4s 3d. Maar let op dat 1s 2s 2p 3s 3p die konfigurasie van die edelgas argon is. Vervang net hierdie deel van die sinknotasie met die chemiese simbool van argon tussen vierkantige hakies ([Ar].) Dus kan die verkorte notasie van die elektronkonfigurasie van sink geskryf word as [Ar]4s 3d. 
Gaan na die nommers 1 tot 8 onderaan (die basis) van die tabel. Dit is die nommers van die elektronskulpe, of die kolomme. Ignoreer die deurgehaalde kolomme. Die kolomme wat oorbly vir erbium is 1,2,3,4,5 en 6. Let wel: Die bogenoemde elektronkonfigurasie van Er (erbium) word in die volgorde van stygende dopnommers gelys. Dit kan ook in die volgorde van die orbitale geskryf word. Volg net die kaskenades van bo na onder, in plaas van die kolomme, as jy die kolomgroepe neerskryf: 1s 2s 2p 3s 3p 4s 3d 4p 5s4d 5p 6s 4f. kr(..., 3d5, 4s1); Cu(..., 3d10, 4s1); NB(..., 4d4, 5s1); ma(..., 4d5, 5s1); ru(..., 4d7, 5s1); Rh(..., 4d8, 5s1); pd(..., 4d10, 5s0); Ag(..., 4d10, 5s1); La(..., 5d1, 6s2); Ce(..., 4f1, 5d1, 6s2); God(..., 4f7, 5d1, 6s2); au(..., 5d10, 6s1); ac(..., 6d1, 7s2); wel(..., 6d2, 7s2); pa(..., 5f2, 6d1, 7s2); JY(..., 5f3, 6d1, 7s2); np(..., 5f4, 6d1, 7s2) en cm(..., 5f7, 6d1, 7s2).
Skryf van elektronkonfigurasies vir elemente
Inhoud
Die elektronkonfigurasie van `n atoom is `n numeriese voorstelling van die elektronorbitale. Elektronorbitale is gebiede met verskillende vorms rondom die kern van `n atoom, waar wiskundig gedemonstreer kan word dat daar `n kans is dat elektrone daar aanwesig is. Dit is maklik en vinnig om uit `n elektronkonfigurasie te lees hoeveel elektronorbitale `n atoom het en hoeveel elektrone in elke orbitaal teenwoordig is. Hier sal jy leer hoe om jou eie elektronkonfigurasie te begin skep.
Trappe
Metode 1 van 2: Metode een: Ken elektrone toe deur die periodieke tabel te gebruik

1. Vind die atoomgetal. Elke atoom het `n geassosieerde spesifieke aantal elektrone. Vind die chemiese simbool van jou atoom in die periodieke tabel. Die atoomgetal is `n positiewe heelgetal wat by 1 begin (vir waterstof) en met 1 toeneem vir elke daaropvolgende atoom. Die atoomgetal is die aantal protone in daardie atoom - dit is dus ook die aantal elektrone in daardie atoom as dit ongelaai is.
2. Bepaal die lading van die atoom. Ongelaaide atome het presies dieselfde aantal protone as elektrone, soos aangedui in die periodieke tabel. Maar dit is nie die geval met gelaaide atome nie. As jy met `n gelaaide atoom te doen het, tel of trek die elektrone soos volg by: tel een elektron by vir elke negatiewe lading en trek een af vir elke positiewe lading.
3. Memoriseer die basiese lys orbitale. Wanneer `n atoom elektrone bykry, vul hulle verskillende stelle orbitale in `n vaste volgorde. Elke orbitaal, wanneer dit vol is, bevat `n vaste aantal elektrone. Die orbitale vorms is:
4. Verstaan die notasie van `n elektronkonfigurasie. Elektronkonfigurasies word op so `n manier aangeteken dat dit duidelik is hoeveel elektrone in die atoom teenwoordig is, en hoeveel elektrone in elke orbitaal is. `n Orbitaal het `n vaste notasie met die aantal elektrone in boskrif na die naam van die orbitaal. Die finale elektronkonfigurasie is `n reeks orbitale vorms en boskrifte.
5. Leer die volgorde van die orbitale.Let daarop dat die orbitaalvorms deur die elektronskulp genommer word, maar volgens energievlak georden word. Byvoorbeeld, `n volledig gevulde 4s het minder energie (of minder potensiaal) as `n gedeeltelik gevulde of gevulde 3d, so die 4s dop is voor. As jy die volgorde van die orbitale ken, is dit nie moeilik om hulle volgens die aantal elektrone in die atoom te vul nie. Die volgorde waarin die orbitale gevul word, is soos volg: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
6. Vul die orbitale volgens die aantal elektrone in jou atoom. Byvoorbeeld, as ons die elektronkonfigurasie van `n ongelaaide kalsiumatoom wil skryf, sal ons begin deur die atoomgetal in die periodieke tabel op te soek. Die atoomgetal van kalsium is 20, so ons skryf `n konfigurasie vir hierdie atoom met 20 elektrone in die volgorde hierbo getoon.
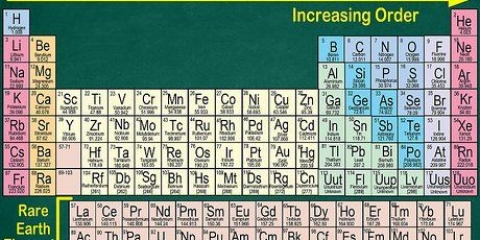
7. Gebruik die periodieke tabel as `n visuele hulpmiddel. Jy het dalk opgemerk dat die volgorde van die periodieke tabel ooreenstem met die volgorde van die orbitale vorms in elektronkonfigurasies. Byvoorbeeld, atome in die tweede kolom aan die linkerkant eindig altyd met "s", atome heel regs in die smal middelste gedeelte eindig altyd in "d," ens. Gebruik die periodieke tabel as `n visuele gids om konfigurasies aan te teken – die volgorde waarin jy elektrone by die orbitale voeg stem ooreen met die posisie in die tabel van die periodieke tabel. Kyk mooi na die volgende:
8. Leer snelskrif vir die skryf van lang elektronkonfigurasies. Die atome langs die regterkant van die periodieke tabel word die genoem edelgasse. Hierdie elemente is baie stabiel. Om die proses van notering van `n lang elektronkonfigurasie te verkort, skryf die chemiese simbool van die naaste gas, met minder elektrone as jou atoom, tussen vierkantige hakies, en gaan dan voort met die elektronkonfigurasie vir die volgende orbitaalvorms. Sien onder:
Metode 2 van 2: Metode Twee: Maak gebruik van `n ADOMAH periodieke tabel

1. Verstaan die ADOMAH Periodieke Tabel. Met hierdie metode om elektronkonfigurasies op te let, is dit nie nodig om baie te memoriseer nie. Maar dit vereis wel `n anders gerangskik periodieke tabel, want binne die tradisionele periodieke tabel stem die elektronskulpe, vanaf die vierde ry, nie ooreen met die periodieke getalle nie. Probeer om `n voorbeeld van hierdie stelsel wat deur Valery Tsimmerman ontwerp is aanlyn te vind. Dit is sekerlik nie `n probleem nie.
- Binne die ADOMAH Periodieke Tabel verteenwoordig die rye groepe elemente, soos halogene, inerte gasse, alkalimetale, ens.Die kolomme stem ooreen met die elektronskulpe en die "kaskenades" (skuinslyne wat s,p,d en f groepe verbind) stem ooreen met die periodes.
- Helium is nou langs waterstof omdat albei deur die 1s-orbitaal gekenmerk word. Die punte (s,p,d en f) is aan die regterkant en die dopnommers onderaan die tabel. Elemente word in blokkies genommer 1 tot 120 gelys. Hierdie getalle staan vir die gewone atoomgetalle en dui die aantal elektrone in `n neutrale atoom aan.
2. Soek vir jou atoom in die ADOMAH-tabel. Om die elektronkonfigurasie van `n element te kan neerskryf, soek na sy simbool in die ADOMAH Periodieke Tabel en trek alle elemente met hoër atoomgetalle deur. Byvoorbeeld, as jy die elektronkonfigurasie van erbium (68) wil weet, kruis elemente 69 tot 120.
3. Tel die orbitale tot by jou atoom. Deur na die groep simbole aan die regterkant van die tabel (s, p, d en f) en die kolomnommers onderaan die tabel te kyk en die diagonale lyne tussen hulle te ignoreer, kan jy die kolomme in groepe verdeel en lys van onder na bo. Weereens, ignoreer daardie blokke met alle elemente deurgehaal. Skryf die kolomgroepe neer, begin met die kolomnommer gevolg deur die groepsimbool, soos volg: 1s2s2p3s3p3d4s4p4d4f5s5p6s (in die geval van erbium).
4. Tel die elektrone van elke orbitaalvorm. Tel die elemente wat nie in elke kolomgroep deurgehaal is nie, kies een elektron per element, en skryf die getal langs die groepsimbole van elke kolomgroep soos volg neer: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s. Dit is die elektronkonfigurasie van Er (erbium) uit ons voorbeeld.
5. Ken die onreëlmatige elektronkonfigurasies. Daar is agtien uitsonderings op die elektronkonfigurasies in atome van die laagste energievlak, ook bekend as die grondtoestand. Dit wyk af van die algemene reël vir die laaste twee of drie elektronposisies. In hierdie gevalle hou die werklike elektronkonfigurasies die elektrone op `n laer energievlak as in `n standaardkonfigurasie van daardie atoom. Die onreëlmatige atome is:
Wenke
- Om die atoomgetal van `n atoom te vind wanneer dit in die vorm van `n elektronkonfigurasie geskryf is, tel al die nommers wat na die letters (s, p, d en f) kom, by. Dit werk net op `n neutrale atoom, nie `n ioon nie, en jy moet al die elektrone wat verloor of bygevoeg word aftrek of bytel.
- Die nommer na die letter is eintlik boskrif, maak dus geen fout hieroor met `n toets nie.
- Daar is nie iets soos die "stabiliteit van `n half-gevulde" subvlak. Dit is te eenvoudig. Die stabiliteit is omdat elke orbitaal deur slegs een elektron beset word, dus is elektron-elektronafstoting minimaal.
- Elke atoom wil terugkeer na `n stabiele toestand, en die mees stabiele konfigurasies het heeltemal gevulde s en p (s2 en p6) orbitale. Die edelgasse het hierdie konfigurasie, dit is hoekom hulle amper nooit reaktief is nie en sit aan die regterkant van die periodieke tabel. Dus, as `n konfigurasie met 3p eindig, benodig dit net nog twee elektrone om stabiel te word (om ses elektrone te verloor, insluitend dié van die s-orbitaal, neem meer energie, so dit is makliker om vier te verloor). En as `n konfigurasie met 4d eindig, hoef dit net nog drie elektrone te verloor om tot `n stabiele toestand te kom. Dit geld ook dat halfgevulde skulpe (s1, p3, d5..) meer stabiel is as byvoorbeeld p4 of p2; s2 en p6 sal selfs meer stabiel word.
- Wanneer die atoom `n ioon is, beteken dit dat die aantal protone nie gelyk is aan die aantal elektrone nie. Die lading van die atoom word dan gewoonlik in die regter boonste hoek van die simbool aangedui. Dus, `n antimoonatoom met `n lading +2 het `n elektronkonfigurasie van 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Let daarop dat die 5p verander is na 5p. Wees bewus hiervan as die konfigurasie van `n ongelaaide atoom op enigiets behalwe `n s- en p-orbitaal eindig. As jy elektrone verwyder, kan jy dit net by die valensorbitale (die s- en p-orbitale) doen. Dus as `n konfigurasie eindig met 4s 3d, en die lading van die atoom neem toe met +2, dan verander die konfigurasie sodat dit eindig met 4s 3d. Onthou dat 3dnie verander, maar dat die s-orbitaal sy elektrone verloor.
- Daar is omstandighede waar `n elektron `n hoër vlak kry. Wanneer `n orbitaal net een elektron weg is om half of heeltemal gevul te wees, verwyder `n elektron van die naaste s- of p-orbitaal en skuif dit na die orbitaal wat daardie elektron benodig.
- Jy kan ook `n element se elektronkonfigurasie neerskryf deur net sy valensiekonfigurasie, die laaste s en p orbitaal neer te skryf. Dus, die valensiekonfigurasie van antimoon word dan 5s 5p.
- Ione is nie dieselfde nie, maar baie moeiliker. Slaan twee vlakke oor en volg dan dieselfde patroon, afhangend van waar jy begin het en die aantal elektrone.
Artikels oor die onderwerp "Skryf van elektronkonfigurasies vir elemente"
Оцените, пожалуйста статью
Gewilde