Byvoorbeeld: distikstofheksafluoried. Die eerste element is stikstof en die chemiese simbool vir stikstof is N. 
Byvoorbeeld: Dinitrogeen het die voorvoegsel `di-` wat 2 beteken; Daar is dus twee atome stikstof teenwoordig. Skryf dinitrogeen as N2. 
Byvoorbeeld: Dinitrogen Hexafluoride. Die tweede element is fluoor. Laat net die `-ide`-einde weg om die werklike naam van die element te kry. Die chemiese simbool vir fluoor is F. 
Byvoorbeeld: Heksafluoried het die voorvoegsel `heksa-` wat 6 beteken; Dit is hoekom daar 6 atome fluoor teenwoordig is. Skryf heksafluoried as F6. Die finale chemiese formule vir distikstofheksafluoried is N2f6. 
Swaweldioksied: SO2 Koolstoftetrabromied: CBr4 Difosforpentoksied: P2O5 

Daar is slegs 3 poliatomiese katione, en dit is ammonium (NH4), hidronium (H3) en kwik (I) (Hg2 Die res van die poliatomiese ione het negatiewe ladings wat wissel van -1 tot -4. Enkele algemene voorbeelde is karbonaat (CO3), sulfaat (SO4), nitraat (NO3) en chromaat (CrO4). 
Alle elemente in groep 1 is 1+. Alle elemente in groep 2 is 2+. Oorgangselemente het Romeinse syfers om hul lading aan te dui. Silwer is 1+ Sink is 2+ en aluminium is 3+. Groep 17 is 1-. Groep 16 is 2-. Groep 15 is 3-. Onthou dat wanneer jy met poliatomiese ione te doen het, jy net voordeel kan trek uit die lading van die ioon. 
Byvoorbeeld: Litiumoksied. Litium is `n groep 1 element en het `n lading van 1+. Suurstof is `n groep 16 element en het `n lading van 2-. Om die lading 2- van suurstof te balanseer, benodig jy 2 litiumatome; Daarom is die chemiese formule van litiumoksied Li2O. 
Kalsiumnitried: Die simbool vir kalsium is Ca en die simbool vir stikstof is N. Ca is `n element van groep 2 en het `n lading van 2+. Stikstof is `n groep 15 element en het `n lading van 3-. Om dit te balanseer, benodig jy 3 kalsiumatome (6+) en 2 stikstofatome (6-): Ca3N2. Kwik(II)-fosfaat: Die simbool vir Kwik is Hg en fosfaat is die poliatomiese ioon PO PO4. Mercurius het `n lading van 2+ soos langsaan aangedui deur die Romeinse getal II. Fosfaat het `n lading van 3-. Om dit te balanseer, benodig jy 3 kwikatome (6+) en 2 fosfaatmolekules (6-): Hg3(PO4)2. 

Onthou om die ladings te balanseer wanneer nuwe verbindings gevorm word. Byvoorbeeld: AgNO3 + NaCl --> ? Ag is nou aan Cl gekoppel om AgCl te vorm. Na is nou gekoppel aan NO3 na NaNO3 te vorm. 
Byvoorbeeld: AgNO3 + NaCl --> ? AgNO3 + NaCl --> AgCl + NaNO3 
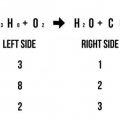
Byvoorbeeld: AgNO3 + NaCl --> AgCl + NaNO3 Tel die aantal atome aan beide kante: 1 Ag aan die linkerkant, 1 Ag aan die regterkant; 1 N links, 1 N regs; 3 O links, 3 O regs; 1 Na links, 1 Na regs; 1 Cl links, 1 Cl regs. Hierdie reaksievergelyking is in ewewig omdat daar dieselfde aantal atome aan beide die linker- en regterkant van die vergelyking is. 
NiCl2 + (NH4)2s --> ? Katione: Ni en NH4 Anione: Cl en S Herrangskik die ione om nuwe produkte te skep: NiS + NH4Cl Skryf die vergelyking: NiCl2 + (NH4)2s --> NiS + NH4Cl Balanseer die vergelyking: NiCl2 + (NH4)2s --> NiS + 2NH4Cl
Maak 'n chemiese vergelyking
Inhoud
`n Goeie manier om oor `n chemiese reaksie te dink, is die proses om koekies te bak. Jy meng die bestanddele (meel, botter, sout, suiker en eiers), bak die beslag en jy sien dit verander in iets nuuts. Koekies. In chemiese terme is die resep die vergelyking, die bestanddele is die `reaktante` en die koekies is die `produkte`. Alle reaksievergelykings lyk iets soos `A + B --> C (+ D..)`, waar elke hoofletter `n element of `n molekule is (`n versameling atome wat deur chemiese bindings bymekaar gehou word). Die pyltjie dui die reaksie of verandering aan wat plaasvind. Om die vergelykings te skryf is daar `n paar belangrike naamreëls wat jy sal moet ken.
Trappe
Deel 1 van 3: Skryf van chemiese formules van kovalente bindings

1. Leer die voorvoegsels vir die aantal atome. Wanneer verbindings benoem word, word Griekse voorvoegsels gebruik om die aantal atome in elke element aan te dui. Kovalente bindings het die eerste element volledig uitgeskryf, terwyl die tweede element `n agtervoegsel `-ide` kry. Byvoorbeeld, difosforpentaoksiedtrisulfied het die chemiese formule P2s3. Dit is die voorvoegsels vir 1-10:
- 1: mono-
- 2: di-
- 3: drie-
- 4: tetra-
- 5: Penta-
- 6: heksa-
- 7: hepta-
- 8: okt-
- 9: nee-
- 10: Deka-

2. Skryf die chemiese simbool vir die eerste element neer. Wanneer `n verbinding uitgeskryf word, moet jy die elemente aandui en hul chemiese simbole ken. Die eerste element wat neergeskryf word, is die `voornaam` van die komposisie. Gebruik die periodieke tabel om die chemiese simbool van `n element te vind.

3. Voeg die aantal atome as subskripsie by. Om die aantal atome teenwoordig vir elke element te identifiseer, hoef jy net na die element se voorvoegsel te kyk. Deur die Griekse voorvoegsels te memoriseer, sal dit jou help om chemiese formules vinnig neer te skryf, sonder om iets na te soek.

4. Skryf die chemiese simbool vir die tweede element neer. Die tweede element is die `van` van die stof en volg na die eerste element. In kovalente bindings het die name van die elemente die agtervoegsel `-ide` in plaas van die normale terminering van die element.

5. Voeg in onderskrif die aantal atome teenwoordig by. Soos met die eerste element, bepaal jy die aantal atome in die tweede element deur die voorvoegsel te lees. Met hierdie voorvoegsel skryf jy die aantal atome as `n subskripsie regs van die chemiese simbool.

6. Oefen met `n paar voorbeelde. As jy net met chemie begin, is daar baie om te memoriseer. Dit is soos om `n nuwe taal te leer. Hoe meer jy oefen met voorbeeldprobleme, hoe makliker sal dit wees om chemiese formules in die toekoms te ontsyfer en die taal van chemie te leer.
Deel 2 van 3: Skryf van chemiese formules van ioniese bindings

1. Bepaal die chemiese simbole vir die katione en anione. Alle chemikalieë het `n voornaam en van. Die voornaam is die katioon (positiewe ioon) terwyl die achternaam die anioon (negatiewe ioon) is. Katione word as elementnaam geskryf terwyl anione die naam is van die element wat eindig met die agtervoegsel `-ide`.
- Die chemiese simbool vir elke element kan op die periodieke tabel gevind word.
- Anders as die kovalente bindings word Griekse voorvoegsels nie gebruik om die aantal atome van elke element aan te dui nie. Jy moet die ladings van die elemente balanseer om die aantal atome te bepaal.
- Byvoorbeeld: Litiumoksied is Li2O.

2. Herken poliatomiese ione. Soms is die katioon of anioon `n poliatomiese ioon. Dit is molekules wat twee of meer atome met ioniese groepe bevat. Daar is geen truuk om dit te onthou nie, jy sal hulle net moet memoriseer.

3. Bepaal die valensie van elke element. Die valensie kan bepaal word deur na die posisie van die element in die periodieke tabel te kyk. Daar is `n paar reëls om in gedagte te hou wat jou kan help om vragte te bepaal:

4. Balanseer die positiewe en negatiewe ladings van die ione. Sodra jy die lading van elke element (of poliatomiese ioon) bepaal het, sal jy hierdie ladings gebruik om die aantal atome teenwoordig in elke element te bepaal. Die bedoeling is om die lading van die verbinding op nul te stel, so jy gaan atome byvoeg om die ladings te balanseer.

5. Oefen met `n paar voorbeelde. Die beste manier om te leer om formules te skryf, is om met baie voorbeelde te oefen. Gebruik voorbeelde in jou chemiehandboek of kyk aanlyn vir oefenoefeninge. Doen soveel as wat jy kan totdat jy die skryf van chemiese formules bemeester.
Deel 3 van 3: Bepaal die produkte van gegewe reaktante

1. Bepaal alle katione en anione in die reaktante. In die vergelyking van `n eenvoudige dubbelvervangingsvergelyking is daar twee katione en anione. Die algemene vergelyking is in die vorm van AB + CD --> AD + CB, waar A en C katione is en B en D anione is. Bepaal ook die lading van elke ioon.
- Byvoorbeeld: AgNO3 + NaCl --> ?
- Die katione is: Ag. Die anione is: NEE3 en Cl.

2. Ruil die ione om die produkte te skep. Sodra jy al die ione en hul ladings bepaal het, rangskik hulle so dat die eerste katioon aan die tweede anioon gekoppel is, en die tweede katioon is gekoppel aan die eerste anioon. Onthou die vergelyking: AB + CD --> AD + CB.

3. Skryf die volledige vergelyking neer. Nadat jy die produkte wat in die vergelyking vorm geskryf het, kan jy die hele vergelyking met beide die produkte en die reaktante skryf. Plaas die reaktante aan die linkerkant van die vergelyking en skryf die nuwe produkte aan die regterkant, met `n plusteken tussenin.

4. Bring die vergelykingin balans. Sodra jy die vergelyking geskryf het en al die produkte en reaktante bepaal het, maak seker dat alles in ewewig is. `n Vergelyking is slegs in ewewig wanneer daar dieselfde aantal atome van elke element aan beide kante is.

5. Oefen met `n paar voorbeelde. Die enigste manier om beter te word om vergelykings te skryf, is om dit werklik te oefen. Werk deur die volgende voorbeelde om seker te maak jy verstaan die proses werklik.
Artikels oor die onderwerp "Maak 'n chemiese vergelyking"
Оцените, пожалуйста статью
Gewilde