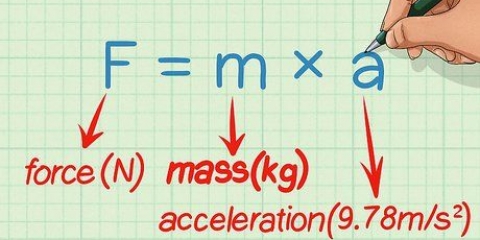Voorbeeld: Al2O3. Reeds2 = Aluminium; O3 = suurstof. So die naam word "aluminiumoksied". 
Voorbeeld: FeCl2 en FeCl3. Fe = Yster; Cl2 = Chloried -2;Cl3 = Chloried -3. Die name sou yster(II)chloried en yster(III)chloried wees. 

Verwyder `n suurstofatoom uit die binding. Die aanklag bly dieselfde en die einde van die verbandnaam verander van “-aat” na “–iet”. As voorbeeld: NEE3 na NEE2 verander van "nitraat" na "nitriet".”
Vervang die sentrale atoom met `n ander van dieselfde periodieke groep. As `n voorbeeld: Sulfaat SO4 kan verander in Selenate SeO4.

Hidroksied-ioon: OH Nitraation: NEE3 Suurstofkarbonaat-ioon: HCO3 Permanganaatioon: MnO4 Karbonaatioon: CO3 Chromaatioon: CrO4 Digromaatioon: Kr2O7 Sulfaation: SO4 Sulfiet-ioon: SO3 Tiosulfaatioon: S2O3<2- fosfaation: PO4 Ammoniumioon: NH4 Voorbeeld: KMnO4. Jy kan die MnO gebruik4 ioon moet erken as permanganaat. K is kalium, dus die naam van die binding is kaliumpermanganaat.
Voorbeeld: NaOH. Jy moet die OH-ioon as hidroksied herken. Na is natrium, so die naam van die binding sal natriumhidroksied wees.


1 atoom - "Mono-" 2 atome - "Di-" 3 atome - "Drie-" 4 atome - "Tetra-" 5 atome - "Penta-" 6 atome - "Hexa-" 7 atome - "Hepta-" 8 atome - "Octa-" Voorbeeld: CO word dan koolstofmonoksied en CO2 word koolstofdioksied.
Voorbeeld: N2s3 word dan distikstoftrisulfied.
In die meeste gevalle kan die voorsetsel "mono-" weggelaat word, aangesien dit bedoel word wanneer dit nie teenwoordig is nie. Dit word steeds vir koolstofmonoksied gebruik as gevolg van die feit dat die term sedert vroeë chemie in gebruik is.
Benoem chemiese bindings
Inhoud
Om die standaard chemiese bindings te benoem is noodsaaklik om suksesvol te wees in chemie. Volg hierdie gids vir `n paar basiese reëls oor hoe chemiese bindings hul name kry, en om te leer hoe om chemiese bindings te benoem waarmee jy nie vertroud is nie.
Trappe
Metode 1 van 3: Benoem ioniese bindings

1. Verstaan hoekom iets `n ioniese binding is. Ioniese bindings bevat `n metaal en `n nie-metaal. Raadpleeg die periodieke tabel van elemente om te sien tot watter kategorie die elemente in die verband behoort.

2. Vorm die naam. Die benaming van `n ioniese binding van twee elemente is eenvoudig. Die eerste deel van die naam is die naam van die metaal. Die tweede deel is die naam van die nie-metaal, met die agtervoegsel "-ide.”

3. Herken oorgangsmetale. Metale in die d- en f-blokke van die periodieke tabel staan bekend as oorgangsmetale. Hulle lading word deur `n Romeinse syfer aangedui wanneer die naam van die verband neergeskryf word. Dit is omdat hulle meer as een lading kan hê en meer as een binding kan vorm.
Metode 2 van 3: Die benaming van poliatomiese bindings

1. Verstaan wat `n poliatomiese binding is. Hierdie bindings bestaan uit groepe atome wat saamgebind is, met die hele groep wat `n negatiewe of positiewe lading het. Jy kan drie dinge met poliatomiese bindings doen:
- Voeg `n waterstofatoom by aan die begin van die binding. Die woord "waterstof" word aan die begin van die bindingsnaam bygevoeg. Dit verminder die negatiewe lading met een. As `n voorbeeld, "karbonaat" CO3 word "waterstofkarbonaat" HCO3.




2. Memoriseer die mees algemene ioongroepe. Dit vorm die basis vir die maak van die meeste poliatomiese bindings. In volgorde van groter negatiewe lading is hulle:
3. Skep bindende name gebaseer op die lys. Sluit elke element wat aan die groepioon behoort in die naam in. As die element voor die ioniese groep kom, moet jy net die naam van die element aan die begin van die naam van die binding byvoeg.


Metode 3 van 3: Die benaming van kovalente bindings

1. Verstaan wat `n kovalente binding is. Kovalente bindings word gevorm deur twee of meer nie-metale. Die naam van die binding is gebaseer op die hoeveelheid atome teenwoordig. Die voorsetsel wat bygevoeg word, is die Latynse term vir die hoeveelheid molekules.

2. Leer die voorsetsels. Memoriseer die voorsetsels tot 8 atome:
3. Noem die bindings. Benoem die nuwe verband deur voorsetsels te gebruik. Jy heg voorsetsels aan enige deel van die binding wat veelvuldige atome het.



Wenke
- Dit is ook baie belangrik om te verstaan dat dit nie van toepassing is op biochemie nie.
- Hierdie reëls is gemaak vir mense wat net begin met chemie en wetenskap. Daar is verskillende reëls wanneer jy by gevorderde chemie kom, byvoorbeeld die reëls vir veranderlike valensie.
- Natuurlik het hierdie reëls almal baie uitsonderings. Byvoorbeeld, selfs al het CaCl2 `n 2 aan die einde, word dit steeds kalsiumchloried genoem en NIE kalsiumdichloried nie, soos verwag sou word.
Artikels oor die onderwerp "Benoem chemiese bindings"
Оцените, пожалуйста статью
Gewilde