Li2S = litiumsulfied
Ag2S = silwer sulfied
MgCl2 = Magnesiumchloried












Noem ioniese bindings
Inhoud
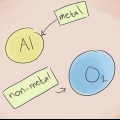
Ioniese bindings bestaan uit katione (positiewe ione) en anione (negatiewe ione). Ioniese bindings bestaan gewoonlik uit `n metaal en een of meer nie-metale. Om `n ioniese binding te noem, moet jy net die naam van die katioon en anioon wat in die verbinding teenwoordig is, vind. Jy moet eers die naam van die metaal neerskryf, gevolg deur die naam van die nie-metaal met die ooreenstemmende nuwe einde. As jy wil weet hoe om ioniese bindings in verskillende situasies te noem, volg net hierdie stappe.
Trappe
Metode 1 van 3: Basiese ioniese bindings

1. Skryf die formule van die ioniese binding. Kom ons sê die ioniese binding waaraan jy werk NaCl is.

2. Skryf die naam van die metaal, of katioon, neer. Dit is die positief gelaaide ioon in die binding en dit word altyd eerste geskryf in die formule van `n ioniese binding. Na natrium is. So skryf Natrium aan.

3. Skryf die naam van die nie-metaal, of anioon, met die "-idee" Verlaat.Cl is chloor (chloor). Rondom die "idee" om einde by te voeg, benodig jy net die laaste lettergreep "-ine" vervang te word deur "-idee". Chloor word chloried.

4. Kombineer die name. NaCl kan geskryf word as natriumchloried.

5. Oefen om eenvoudige ioniese bindings te benoem. Sodra jy in hierdie formule geslaag het, probeer om `n paar meer eenvoudige ioniese bindings te noem. Om selfs `n paar te memoriseer, kan jou `n beter begrip gee van hoe om ioniese bindings te noem. Hier is nog `n paar:



Metode 2 van 3: Oorgangsmetale

1. Skryf die formule van die ioniese binding. Oorgangsmetale kan in die middel van die periodieke tabel gevind word. Hulle het hul naam gekry omdat hul oksidasiegetalle, of hul ladings, voortdurend verander. Kom ons sê jy werk met hierdie verband: Fe2O3.

2. Skryf die lading van die metaal neer. Jy weet die metaal sal `n positiewe lading hê sodat jy die 3 van kan gebruik O3 trek deur en skryf dit Fe het `n heffing van +3. (Jy kan, vir die pret, die omgekeerde doen en dit skryf O het `n lading van -2.) Soms sal die aanklag verklaar word.

3. Skryf die naam van die metaal neer. Aangesien jy dit weet Fe yster en dat dit `n lading van +3 het, kan jy Yster(III) te noem. Onthou om slegs Romeinse syfers te gebruik wanneer jy die naam skryf en nie wanneer jy die formule skryf nie.

4. Skryf die naam van die nie-metaal neer. Aangesien jy dit weet O staan vir suurstof, kan jy die gebruik "-idee" voeg uitset by en dit "oksied" te noem.

5. Voeg die eerste en tweede naam saam. Nou het jy dit. Fe2O3 = Yster(III)oksied.

6. Gebruik die ouer benoemingsmetode. Jy gebruik die ouer benamingsmetode, wat ook gebruik word, die "ysterhoudende" en "ferri" name vir die metale, in plaas van die Romeinse syfers. As die metaalioon `n laer oksidasietoestand het (`n laer numeriese lading, waar jy "+" of "-" ignoreer), wat jy gebruik "ysterhoudende". As dit `n hoër lading het, gebruik "ferri". Fe het die laer toestand (Fe het die hoër toestand), so word dit ysterhoudende. Die naam van FeO kan ook geskryf word as ysteroksied.

7. Onthou die uitsonderings. Daar is twee oorgangsmetale wat geen vaste lading het nie. Dit is sink (Zn) en silwer (Ag). Dit beteken dat jy nie die Romeinse syfers of die ouer benoemingsmetode hoef te gebruik wanneer jy daardie elemente beskryf nie.
Metode 3 van 3: Binding met poliatomiese ione

1. Skryf die formule van die poliatomiese ioon. Hierdie binding sal uit meer as twee ione bestaan. Kom ons sê jy werk aan die volgende verband: FeNH4(SO4)2.

2. Vind die lading van die metaal. Jy sal `n bietjie wiskunde moet doen om dit te vind. Eerstens weet jy dat die sulfaat, of die SO4 ioon, het `n lading van -2 en dat daar twee van hulle is, as gevolg van die 2 onder die hakies. Dus, 2 x -2 = -4. Dan weet jy dat NH4, of die ammoniak-ioon, `n lading van +1 het. Voeg -4 en 1 bymekaar en jy kry -3. Dit beteken dat die ysterioon, Fe, `n lading van +3 moet hê om gelyk te maak en die binding neutraal te maak.

3. Skryf die naam van die metaal neer. In hierdie geval kan jy óf Yster(III) as ferri skryf neer.

4. Skryf die naam van die nie-metaalione neer. In hierdie geval gebruik jy ammonium en sulfaat, of ammoniumsulfaat.

5. Kombineer die naam van die metaal met die name van die nie-metale. Jy kan die verband FeNH noem4(SO4)2 gee ook deur yster(III) ammoniumsulfaat of yster ammoniumsulfaat om te skryf.
Wenke
- As jy in die teenoorgestelde rigting gaan en jy het Romeinse getalle, moet jy `n "X-straal" van die molekule neem. Die Romeinse syfer is die lading van die katioon.
Artikels oor die onderwerp "Noem ioniese bindings"
Оцените, пожалуйста статью
Gewilde