Byvoorbeeld: Die isotoop Ag-107 (silwer) het byvoorbeeld `n atoommassa van 106,90509 vermaak (atoommassa-eenheid). Die isotoop Ag-109 is effens swaarder met `n massa van 108,90470. Die laaste paar desimale plekke kan effens verskil, afhangende van die bron. Moenie getalle tussen hakies ná die massa insluit nie. 
Die isotoop Ag-107 het `n persentasie van 5,86%. AG-109 is effens minder algemeen met `n koers van 48,14%. Dit beteken dat `n spesifieke hoeveelheid silwer 51,86% Ag-107 en 48,14% Ag-109 bevat. Ignoreer alle isotope sonder om die persentasie te spesifiseer. Hierdie isotope kom nie natuurlik op Aarde voor nie. 
In die voorbeeldprobleem is die persentasies: 51.86 / 100 = 0,5186 en 48,14 / 100 = 0,4814. 
Gemiddelde atoommassaAg = (massaAg-107 * persentasieAg-107) + (massaAg-109 * persentasieAg-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107,8677 amu. Soek die element op die periodieke tabel om jou antwoord na te gaan. Die gemiddelde atoommassa word gewoonlik onder die elementsimbool geskryf. 


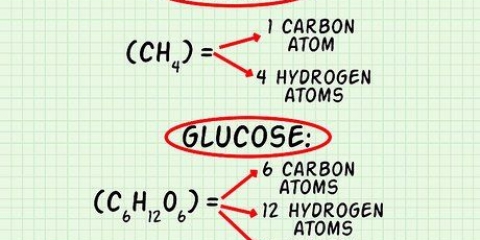
`n Molekule water het die chemiese formule H2O, en bevat dus twee waterstofatome (H) en een suurstofatoom (O). Waterstof het `n gemiddelde atoommassa van 1,00794 amu. Suurstofatome het `n gemiddelde massa van 15,9994 amu. Die gemiddelde massa van `n molekule van H2O is gelyk aan (1,00794)(2) + 15,9994 = 18,01528 amu, gelykstaande aan 18,01528 g/mol.
Berekening van die gemiddelde atoommassa
Inhoud
Gemiddelde atoommassa is nie `n direkte meting van `n enkele atoom nie. In plaas daarvan is dit die gemiddelde massa per atoom van `n spesifieke hoeveelheid van `n gegewe element. As jy die massa van miljarde individuele atome kan meet, kan jy hierdie waarde op dieselfde manier as die gemiddelde bereken. Gelukkig is daar `n meer praktiese metode wat staatmaak op waargenome inligting oor die rariteit van verskillende isotope.
Trappe
Deel 1 van 2: Berekening van die gemiddelde atoommassa

1. Verstaan isotope en atoommassas. Die meeste elemente kom natuurlik in veelvuldige vorme of isotope voor. Die enigste verskil tussen twee isotope van dieselfde element is die aantal neutrone per atoom, en dus die atoommassa. Die gemiddelde atoommassa van `n element neem hierdie variasies in ag, en gee jou die gemiddelde massa per atoom in `n gegewe hoeveelheid van daardie element.
- Byvoorbeeld, die element silwer (Ag) het twee natuurlik voorkomende isotope: Ag-107 en Ag-109 (of Ag en Ag). Isotope is vernoem na die "massagetal", of die som van protone en neutrone in een atoom. Dit beteken dat Ag-109 twee ekstra neutrone per atoom het in vergelyking met Ag-107, en dus effens meer massa.

2. Vind die massa van elke isotoop. Jy benodig twee tipes inligting vir elke isotoop, wat jy kan naslaan in `n naslaanboek of `n aanlyn hulpbron, soos bv web elemente.com. Die eerste is die atoommassa, of die massa van `n atoom van enige isotoop. Isotope met meer neutrone het meer massa.

3. Skryf die oorvloed van elke isotoop neer. Hierdie maatstaf vertel jou hoe algemeen die isotoop is (as `n persentasie van alle atome van die element). Jy kan dit vind in dieselfde bron waar jy die massas gevind het. Die aantal isotope moet tot 100% optel (hoewel dit effens af kan wees as gevolg van afrondingsfoute).

4. Skakel persentasies om na desimale. Deel die persentasie van `n isotoop deur 100 vir die desimale waarde.

5. Bepaal die geweegde gemiddelde van die massas. Die gemiddelde atoommassa van `n element met n isotope gelyk (massaisotoop 1 * persentasieisotoop 1) + (massaisotoop 2 * persentasieisotoop 2) + ... + (massaisotoop n * persentasieisotoop n. Dit is `n voorbeeld van `n "geweegde gemiddelde", wat beteken dat die meer algemene (meer volop) massas `n groter effek op die resultaat het. Hier is hoe om hierdie formule vir silwer te gebruik:
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107,8677 amu.
Deel 2 van 2: Gebruik die resultaat

1. Skakel massa om na aantal atome. Die gemiddelde atoommassa vertel jou die verhouding tussen die massa en aantal atome in `n spesifieke hoeveelheid van die element. Dit is nuttig in eksperimentele chemie, aangesien dit byna onmoontlik is om individuele atome te tel, maar maklik om massa te meet. Byvoorbeeld, jy kan `n monster silwer weeg en voorspel dat elke massa van 107,8677 amu een silwer atoom bevat.

2. Skakel om na molêre massa. Atoommassa-eenhede is baie klein, so chemici weeg gewoonlik hoeveelhede atome in gram. Gelukkig is hierdie terme gedefinieer om die omskakeling so maklik as moontlik te maak. Jy hoef net die gemiddelde atoommassa te vermenigvuldig met 1 g/mol (die molêre massa konstante) vir `n antwoord in g/mol. Byvoorbeeld, 107,8677 gram silwer bevat gemiddeld een mol silweratome.

3. Bepaal die gemiddelde molekulêre massa. Aangesien `n molekule bloot `n versameling atome is, kan jy die massas van die atome bymekaar tel om die massa van die molekule te bepaal. As jy die gemiddelde atoommassa gebruik (eerder as die massa van `n bepaalde isotoop), is die antwoord die gemiddelde molekulêre massa soos gevind in `n natuurlike hoeveelheid. Hier is `n voorbeeld:
Wenke
- Die term relatiewe atoommassa word soms as `n sinoniem vir gemiddelde atoommassa gebruik. Daar is egter `n geringe verskil aangesien die relatiewe atoommassa geen eenhede het nie; dit is `n maatstaf van die massa relatief tot die C-12 koolstofatoom. Solank jy egter atoommassa-eenhede in jou gemiddelde massaberekening gebruik, is die twee waardes numeries identies.
- Die getal tussen hakies na `n atoommassa is die onsekerheid van die finale getal. Byvoorbeeld: `n Atoommassa van 1,0173(4) beteken dat tipiese monsters binne `n foutmarge van ±0,0004 het. Jy hoef dit nie in ag te neem tensy die probleem dit vereis nie.
- Met seldsame uitsonderings het elemente verder af in die periodieke tabel `n hoër gemiddelde massa as die elemente voor hulle. Dit is `n vinnige manier om te kyk of jou antwoorde sin maak.
- 1 atoommassa-eenheid word gedefinieer as 1/12 van die massa van `n C-12 koolstofatoom.
- Die oorvloed van die isotope is gebaseer op monsters wat natuurlik op Aarde voorkom. Ongewone stowwe, soos `n meteoriet of `n monster wat in `n laboratorium gemaak is, kan verskillende isotoopverhoudings hê en dus `n verskillende gemiddelde atoommassa.
Waarskuwings
- Atoommassas word byna altyd voorgestel as `n atoommassa-eenheid (amu of u) (ook genoem die Dalton of Da). Moet nooit `n ander massa-eenheid (soos kg) agter `n getal plaas sonder om dit om te skakel nie.
Benodigdhede
- Potlood
- Papier
- Sakrekenaar
- Persentasies isotope
- Atoommassa-eenhede van isotope
Artikels oor die onderwerp "Berekening van die gemiddelde atoommassa"
Оцените, пожалуйста статью
Soortgelyk
Gewilde