Omdat atome buitengewoon klein is, werk wetenskaplikes gewoonlik met atome in groter hoeveelhede genoem meul. `n Mol is die hoeveelheid van `n stof met soveel atome as wat daar in 12 gram van die isotoop koolstof-12 sou wees. Hierdie getal is ongeveer 600 triljoen (6 keer 10 tot die 23ste mag) van atome, en staan bekend as Avogadro se konstante, na die wetenskaplike wat dit gedefinieer het. 


`n Naslaanboek sal verhoudings gee gebaseer op alle bekende hoeveelhede isotope van `n element, terwyl die massaspektrometer die verhoudings sal gee vir die monster wat getoets word. 
In die voorbeeld hierbo: 12 x 0,99 = 11,88 vir koolstof-12, en 13 x 0,01 = 0,13 vir koolstof-13. Die relatiewe atoommassa is 11,88 + 0,13 = 12,01. (As gevolg van die verhoudings van isotope, is die relatiewe atoommassas op periodieke tabelle selde heelgetalle.)
Bereken atoommassa
Inhoud
Atoommassa is die massa van `n spesifieke isotoop van `n gegewe atoom, maar dit word ook misbruik om die gemiddelde gewig van `n monster van verskillende isotope van dieselfde element te beskryf, wat eintlik relatiewe atoommassa of atoomgewig genoem word. Watter waarde jy ook al soek, ons sal jou die stappe wys om atoommassa en relatiewe atoommassa te bereken.
Trappe
Metode 1 van 2: Bereken atoommassa

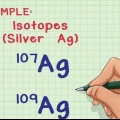
1. Vind die atoomgetal van die element of isotoop. Die atoomgetal is die aantal protone in `n element, en dit verander nooit. Byvoorbeeld: alle waterstofatome, slegs en enigste waterstofatome, het een proton. Koolstof het die atoomgetal 6 omdat sy kern ses protone het terwyl suurstof die atoomgetal 8 het omdat sy kern agt protone het.

2. Bepaal die aantal neutrone in die kern. Die aantal neutrone kan binne `n atoom verskil - hoewel dit dieselfde element is, is daar verskillende isotope van daardie element. Twee isotope van dieselfde element sal dieselfde aantal protone hê, maar `n verskillende aantal neutrone.

3. Ignoreer die aantal elektrone wat om die kern wentel. Die massa elektrone van `n atoom is weglaatbaar in vergelyking met die protone en neutrone in die kern.

4. Voeg die aantal protone en neutrone by. Dit is die atoommassa van daardie atoom.
Metode 2 van 2: Bereken relatiewe atoommassa (atoomgewig)

1. Bepaal die aantal isotope in die monster. Watter isotope in die monster is kan bepaal word deur `n massaspektrometer te gebruik.

2. Bepaal die relatiewe oorvloed van elke isotoop in die monster. Hierdie inligting kan verkry word deur massaspektrometrie of uit `n naslaanboek.

3. Vermenigvuldig die atoommassa van elke isotoop met sy verhouding in die monster. In `n monster wat koolstof-12 en koolstof-13 bevat, as 99 persent van die monster koolstof-12 is, vermenigvuldig 12 met 0,99 en 13 met 0,01.

4. Tel die resultate by. Die totaal is die relatiewe atoommassa, of atoomgewig, van die monster.
Wenke
- Sommige isotope is minder stabiel as ander en breek af in elemente met minder protone en neutrone in hul kerne terwyl hulle dele van hulself afstoot. Hierdie isotope word radioaktief genoem.
Benodigdhede
- Massaspektrometer
- Chemiese naslaanboek
- Sakrekenaar
Artikels oor die onderwerp "Bereken atoommassa"
Оцените, пожалуйста статью
Gewilde