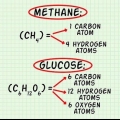
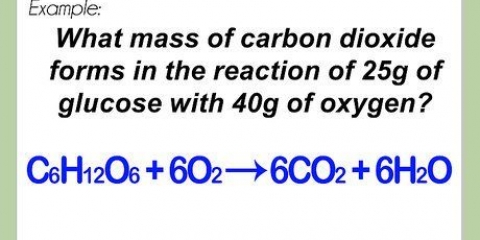In hierdie voorbeeld bevat `n molekule suurstof ( ) twee suurstofatome.
) twee suurstofatome. Die molêre massa van `n suurstofatoom is ongeveer 16 g/mol. Indien nodig, kan jy meer presiese waardes bereken. 2 suurstofatome x 16 g/mol per atoom = 32 g/mol  .
. Die ander reagens, glukose ( ) het `n molêre massa van (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol.
) het `n molêre massa van (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol. As jy hierdie stap in meer besonderhede wil sien, lees Bereken molêre massa. 
Gestel jy begin byvoorbeeld met 40 gram suurstof en 25 gram glukose. 40 g  / (32 g/mol) = 1,25 mol suurstof.
/ (32 g/mol) = 1,25 mol suurstof. 25g  / (180 g/mol) = ongeveer 0,139 mol glukose.
/ (180 g/mol) = ongeveer 0,139 mol glukose. 
In die volgende voorbeeld begin jy met 1,25 mol suurstof en 0,139 mol glukose. Die verhouding van suurstof- en glukosemolekules is dus 1,25/0,139 = 9,0. Hierdie verhouding beteken jy het nege keer soveel molekules suurstof as glukose. 
Vir hierdie reaksie word die reaktante gegee as  . Die koëffisiënte dui aan dat jy ses suurstofmolekules nodig het vir elke molekule glukose. Die ideale verhouding vir hierdie reaksie is 6 suurstof / 1 glukose = 6,0.
. Die koëffisiënte dui aan dat jy ses suurstofmolekules nodig het vir elke molekule glukose. Die ideale verhouding vir hierdie reaksie is 6 suurstof / 1 glukose = 6,0. 
In die volgende voorbeeld begin jy met nege keer soveel suurstof as glukose, gemeet aan die aantal mol. Die formule sê vir jou dat jou ideale verhouding ses keer soveel suurstof tot glukose is. Jy benodig dus meer suurstof as glukose. Die ander reagens, glukose in hierdie geval, is dus die beperkende reagens. 

In die voorbeeld hierbo is glukose die beperkende reagens. Volgens die molêre massaberekeninge is die eerste 25 g glukose gelyk aan 0,139 mol glukose. 
Die ewewigsreaksie vir hierdie voorbeeld is  →
→  . Hierdie vergelyking sê vir jou dat jy ses molekules van die verlangde produk, koolstofdioksied (
. Hierdie vergelyking sê vir jou dat jy ses molekules van die verlangde produk, koolstofdioksied ( ), en een molekule glukose (
), en een molekule glukose ( ).
). Die verhouding van koolstofdioksied en glukose is 6/1 = 6. Met ander woorde, hierdie reaksie kan ses molekules koolstofdioksied uit een molekule glukose produseer. 
In hierdie voorbeeld is die 25 g glukose gelyk aan 0,139 mol glukose. Die verhouding tussen koolstofdioksied en glukose is 6:1. Jy verwag om ses keer soveel mol koolstofdioksied te kan produseer as die mol glukose waarmee jy begin het. Die teoretiese opbrengs van koolstofdioksied is (0,139 mol glukose) x (6 mol koolstofdioksied/mol glukose) = 0,834 mol koolstofdioksied. 
In die volgende voorbeeld is die molêre massa van CO2 ongeveer 44 g/mol. (Die molêre massa van koolstof is ~12 g/mol en van suurstof ~16 g/mol, dus die totaal is 12 + 16 + 16 = 44). Vermenigvuldig 0,834 mol CO2 x 44 g/mol CO2 = ~36.7 gram. Die teoretiese opbrengs van die eksperiment is 36,7 gram CO2. 
In hierdie voorbeeld is water die tweede produk  . Volgens die ewewigsreaksie kan jy ses molekules water van een molekule glukose verwag. Dit is `n verhouding van 6:1. So 0,139 mol glukose behoort tot 0,834 mol water te lei.
. Volgens die ewewigsreaksie kan jy ses molekules water van een molekule glukose verwag. Dit is `n verhouding van 6:1. So 0,139 mol glukose behoort tot 0,834 mol water te lei. Vermenigvuldig die mol water met die molêre massa water. Die molêre massa is 2 + 16 = 18 g/mol. Vermenigvuldig met die produk lei dit tot 0,139 mol H2O x 18 g/mol H2O = ~2,50 gram. Die teoretiese opbrengs van water in hierdie eksperiment is 2,50 gram.
Berekening van teoretiese opbrengs
Inhoud
Teoretiese opbrengs is `n term wat in chemie gebruik word vir die maksimum hoeveelheid van `n stof verkry wat jy van `n chemiese reaksie verwag. Jy begin deur `n reaksievergelyking te balanseer en die beperkende reagens te definieer. Wanneer jy die hoeveelheid reagens meet wat jy wil gebruik, kan jy die hoeveelheid van `n stof wat verkry word, bereken. Dit is die teoretiese opbrengs van die vergelyking. In `n werklike eksperiment sal jy waarskynlik iets daarvan verloor omdat dit nie `n ideale eksperiment is nie.
Trappe
Deel 1 van 2: Bepaling van die beperkende reagens

1. Begin met `n ewewigsreaksie. `n Reaksievergelyking lyk soos `n resep. Dit wys watter reagense (aan die linkerkant) met mekaar reageer om produkte te produseer (aan die regterkant). `n Ekwilibriumreaksie sal dieselfde aantal atome aan die linkerkant van die vergelyking hê (as reaktante) as aan die regterkant (in die vorm van produkte).
- Gestel ons het byvoorbeeld die eenvoudige vergelyking
→
. Daar is twee waterstofatome aan die linker- en regterkant. Maar daar is twee atome suurstof as reaktant aan die linkerkant en net een atoom as produk aan die regterkant.
- Om die vergelyking te balanseer, verdubbel ons die produk, en ons kry
→
.
- Kontroleer die balans. Hierdie verandering het die suurstof laat klop, want dit het nou twee atome aan beide kante. Maar jy het nou twee atome waterstof aan die linkerkant met vier atome waterstof aan die regterkant.
- Verdubbel die waterstof in die reagens. Dit maak die vergelyking
→
. Hierdie verandering het nou gelei tot vier atome waterstof en twee atome suurstof aan weerskante. Die vergelyking is in ewewig.
- ’n Meer ingewikkelde voorbeeld: suurstof en glukose kan reageer om koolstofdioksied en water te vorm:
→
In hierdie vergelyking het elke kant presies 6 koolstofatome (C), 12 waterstofatome (H) en 18 suurstofatome (O). Die vergelyking is in ewewig. - Lees hierdie artikel as jy die reaksievergelykings meer deeglik wil nagaan.

2. Bereken die molêre massa van elke reaksie. Gebruik die periodieke tabel of ander naslaanboek en vind die molêre massa van elke atoom in elke verbinding. Voeg hulle bymekaar om die molêre massa van elke verbinding van reaktante te vind. Doen dit vir `n enkele molekule van die samestelling. Kyk weer na die vergelyking van die omskakeling van suurstof en glukose na koolstofdioksied en water:  →
→ 
 →
→ 
 ) twee suurstofatome.
) twee suurstofatome. .
. ) het `n molêre massa van (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol.
) het `n molêre massa van (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol.
3. Skakel die hoeveelheid van elke reagens om van gram na mol. Vir `n werklike eksperiment sal die massa in gram van elke reagens wat jy gebruik bekend wees. Deel hierdie waarde deur die molêre massa van daardie stof as omskakeling na die aantal mol.
 / (32 g/mol) = 1,25 mol suurstof.
/ (32 g/mol) = 1,25 mol suurstof. / (180 g/mol) = ongeveer 0,139 mol glukose.
/ (180 g/mol) = ongeveer 0,139 mol glukose.
4. Bepaal die molêre verhouding van die reaktante. `n Mol is `n berekeningsinstrument wat in chemie gebruik word om molekules op grond van hul massa te tel. Deur die mol suurstof en glukose te bepaal, weet jy met hoeveel molekules van elkeen jy begin. Om die verhouding van die twee te vind, deel die mol van een reaktant deur die ander s`n.

5. Bepaal die ideale verhouding vir die reaksie. Kyk na die ewewigsreaksie. Die koëffisiënte vir elke molekule vertel jou die verhouding van die molekules wat jy nodig het vir die reaksie om plaas te vind. As jy presies die verhouding gebruik wat deur die formule gegee word, moet beide reaktante gelyk gebruik word.
 . Die koëffisiënte dui aan dat jy ses suurstofmolekules nodig het vir elke molekule glukose. Die ideale verhouding vir hierdie reaksie is 6 suurstof / 1 glukose = 6,0.
. Die koëffisiënte dui aan dat jy ses suurstofmolekules nodig het vir elke molekule glukose. Die ideale verhouding vir hierdie reaksie is 6 suurstof / 1 glukose = 6,0.
6. Vergelyk die verhoudings om die beperkende reagens te vind. In die meeste chemiese reaksies sal een van die reaktante gouer opgebruik word as die ander. Die reagens wat eerste opgebruik word, word die beperkende reagens genoem. Hierdie beperkende reagens bepaal hoe lank die chemiese reaksie kan voortduur, en die teoretiese opbrengs wat jy kan verwag. Vergelyk die twee verhoudings wat jy bereken het om die beperkende reagens te bepaal:
Deel 2 van 2: Bepaling van die teoretiese opbrengs

1. Kyk na die opmerking om die gewenste produk te vind. Die regterkant van `n chemiese vergelyking wys die produkte wat die reaksie produseer. As die reaksie gebalanseerd is, dui die koëffisiënte van elke produk aan hoeveel van elke molekulêre verhouding om te verwag. Elke produk het `n teoretiese opbrengs, of die hoeveelheid produk wat jy sou verwag wanneer die reaksie heeltemal voltooi is.
- Deur die voorbeeld hierbo voort te sit, ontleed jy die reaksie
→
. Die twee produkte aan die regterkant is koolstofdioksied en water.
- Jy kan met enige produk begin as jy die teoretiese opbrengs wil bereken. In sommige gevalle is dit moontlik dat jy net in een van die twee produkte belangstel. Indien wel, is dit die een waarmee jy gaan begin.

2. Skryf die mol van jou beperkende reagens neer. Jy moet altyd die aantal mol beperkende reagens vergelyk met die aantal mol van `n produk. As jy probeer om die massa van elkeen te vergelyk, sal jy nie die korrekte resultaat kry nie.

3. Vergelyk die verhouding tussen die molekules in die produk en die reagens. Keer terug na die ewewigsreaksie. Verdeel die aantal molekules van jou verlangde produk deur die aantal molekules van jou beperkende reagens.
 →
→  . Hierdie vergelyking sê vir jou dat jy ses molekules van die verlangde produk, koolstofdioksied (
. Hierdie vergelyking sê vir jou dat jy ses molekules van die verlangde produk, koolstofdioksied ( ), en een molekule glukose (
), en een molekule glukose ( ).
).
4. Vermenigvuldig hierdie verhouding met die aantal mol van die beperkende reagens. Die antwoord is die teoretiese opbrengs, in mol, van die verlangde produk.

5. Skakel die resultaat om na gram. Dit is die omgekeerde van jou vorige stap om die aantal mol of hoeveelheid reagens te bereken. As jy die aantal mol weet om te verwag, vermenigvuldig dit met die molêre massa van die produk om die teoretiese opbrengs in gram te bepaal.

6. Herhaal die berekening vir die ander produk, indien verlang. In baie eksperimente stel jy dalk net belang in die doeltreffendheid van `n sekere produk. As jy die teoretiese opbrengs van beide produkte wil weet, moet jy net die proses herhaal.
 . Volgens die ewewigsreaksie kan jy ses molekules water van een molekule glukose verwag. Dit is `n verhouding van 6:1. So 0,139 mol glukose behoort tot 0,834 mol water te lei.
. Volgens die ewewigsreaksie kan jy ses molekules water van een molekule glukose verwag. Dit is `n verhouding van 6:1. So 0,139 mol glukose behoort tot 0,834 mol water te lei.Artikels oor die onderwerp "Berekening van teoretiese opbrengs"
Оцените, пожалуйста статью
Soortgelyk
Gewilde