Dit kan nuttig wees om `n vraagteken voor die eenheid te plaas wat jy moet bepaal om jou te help om dit op te los. Kom ons gaan voort met ons voorbeeld. Ons gebruik ons voorbeeldwaardes soos volg: C1V1=C2V2 (5 M)V1=(1mM)(1L). Ons twee konsentrasies het verskillende eenhede. Kom ons stop hier en gaan aan na die volgende stap. 
In ons voorbeeld gebruik ons verskillende eenhede vir die konsentrasie M (molêr) en mM (millimolêr). Kom ons skakel ons tweede meting om na M: 1 mM × 1 M/1 000 mM =0,001 M 
Ons gaan voort met ons voorbeeldprobleem: (5 M)V1=(1mM)(1L). Kom ons V1 los met ons nuwe eenhede. (5 M)V1=(0,001M)(1L) V1=(0,001M)(1L)/(5M). V1=0,0002 l of 0,2 ml 
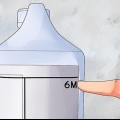
Meet die volume V1 van die oplossing met konsentrasie C1. Voeg dan genoeg verdunningsmiddel (water, ens.) by.), tot `n totale volume van V2. Hierdie nuwe oplossing sal jou die gewenste konsentrasie gee (C2). In ons voorbeeld meet jy byvoorbeeld eers 0,2 ml van die oplossing van ons 5 M oplossing. Voeg dan genoeg water by om die volume van die oplossing tot 1 l te verhoog: 1 l - 0,0002 l = 0,9998 l of 999,8 ml. Met ander woorde, ons voeg 999,8 ml water by ons klein monster van die oplossing. Die nuwe verdunde oplossing het `n konsentrasie van 1 mM, wat ons in die eerste plek wou bereik. 

Byvoorbeeld, as ons 1 koppie gekonsentreerde lemoensap tot `n kwart van die aanvanklike konsentrasie wil verdun, voeg ons by 3 koppies voeg water by die konsentraat. Ons finale mengsel sal dan 1 koppie konsentraat hê vir 4 koppies van die totale vloeistof – `n kwart van die aanvanklike konsentrasie. Hier is `n meer komplekse voorbeeld: as ons 2/3 koppie van `n sekere konsentraat tot `n kwart van die aanvanklike konsentrasie, voeg ons 2 koppies water daarby, want 2/3 koppie is `n kwart van 2&2/3 koppies totale vloeistof. Maak seker dat jy die stowwe by `n houer voeg wat groot genoeg is vir die finale volume wat jy wil hê - `n groot bak of soortgelyke houer. 
Verdunningsoplossings
Inhoud
Verdunning is die proses om `n gekonsentreerde oplossing minder gekonsentreerd te maak. Daar is `n aantal redes waarom `n mens dalk `n verdunning wil uitvoer, wat wissel van ernstig tot meer algemeen. Biochemici maak byvoorbeeld nuwe verdunde oplossings van hul gekonsentreerde vorm vir gebruik in hul eksperimente, terwyl `n kroegman aan die ander kant van die spektrum spiritus met `n koeldrank of sap verdun om `n skemerkelkie lekkerder te maak. Die formele formule vir die berekening van `n verdunning is C1V1=C2V2, waar C1 en C2 verteenwoordig die konsentrasies van die aanvanklike en finale oplossings, onderskeidelik, en V1 en V2 hul volumes verteenwoordig.
Trappe
Metode 1 van 2: Presiese verdunning van konsentrate met die verdunningsvergelyking

1. Bepaal wat jy doen en nie weet nie. Om `n verdunning in chemie uit te voer beteken gewoonlik om `n klein hoeveelheid van `n oplossing met `n bekende konsentrasie te neem, en dan `n neutrale vloeistof (soos water) by te voeg om `n nuwe oplossing met groter volume, maar laer konsentrasie te maak. Dit gebeur dikwels in laboratoriums omdat die reagense om doeltreffendheidsredes dikwels in relatief hoë konsentrasies gestoor word wat verdun word vir gebruik in eksperimente. In die praktyk sal jy gewoonlik die aanvanklike konsentrasie van die oplossing en die konsentrasie en volume van jou tweede, gewenste oplossing ken, maar nie die volume van die eerste oplossing wat jy wil gebruik om daar te kom nie.
- In ander situasies (veral in skooltake), sal jy dalk `n ander stuk van die legkaart moet vind -- byvoorbeeld `n oorspronklike volume en konsentrasie is dalk gegee, opdrag gegee om die finale konsentrasie te bepaal as jy die oplossing kan verdun tot `n sekere volume. In die geval van `n verdunning is dit nuttig om `n oorsig van bekende en onbekende veranderlikes te maak voordat jy begin.
- Kom ons pak `n voorbeeldprobleem aan. Gestel die opdrag is om `n 5 M oplossing met water te verdun om 1 l van `n 1 te maak mM-oplossing te maak. In hierdie geval weet ons die konsentrasie van die beginoplossing en die teikenvolume en konsentrasie wat ons wil bereik, maar nie hoeveel van die oorspronklike oplossing (wat ons met water gaan verdun) ons nodig het om daar te kom.
- Herinnering: In chemie is M `n maatstaf van konsentrasie genoem Molariteit, of die aantal mol van `n stof per liter.

2. Gebruik jou waardes in die formule C1V1=C2V2. In hierdie formule is C1 die konsentrasie van die beginoplossing, V1 die volume van die aanvanklike oplossing, C2 die konsentrasie van die finale oplossing en V2 die volume van die finale oplossing. Deur u gegewe waardes in hierdie vergelyking te gebruik, behoort u die onbekende waarde met `n minimum moeite te gee.

3. Laat asseblief toe vir enige verskille in eenhede. Aangesien verdunnings lei tot veranderinge in konsentrasie (wat soms redelik groot kan wees), is dit nie ongewoon dat twee veranderlikes in jou vergelyking verskillende eenhede het nie. Alhoewel dit maklik misgekyk word, kan eenhede wat nie ooreenstem in jou vergelyking, lei tot `n antwoord in verskeie grootteordes. Voordat u die probleem oplos, moet u alle waardes met verskillende konsentrasie- en/of volume-eenhede nagaan om te skakel.

4. Los op. Wanneer alle eenhede ooreenstem, los die vergelyking op. Dit kan byna altyd met eenvoudige algebra gedoen word.

5. Verstaan hoe om hierdie antwoord prakties te gebruik. Gestel jy het jou ontbrekende waarde gevind, maar jy twyfel oor die toepassing van hierdie nuwe data op `n verdunning wat jy eintlik wil uitvoer. Dit is verstaanbaar – die taal van wiskunde en wetenskap leen hom soms nie goed tot die werklike wêreld nie. As jy al vier waardes in die vergelyking C plaas1V1=C2V2 weet, voer die verdunning soos volg uit:
Metode 2 van 2: Maak maklike, praktiese verdunnings

1. Lees die inligting op die verpakking. Daar is baie redes waarom jy dalk `n verdunning by die huis, in die kombuis of enige ander nie-laboratorium-omgewing wil maak. Byvoorbeeld, die eenvoudige handeling om lemoensap van konsentraat te maak, is `n verdunning. In baie gevalle sal produkte wat verdunning benodig meer inligting oor die verdunning op die verpakking bevat. Hulle kan selfs presiese aanwysings gee om te volg. Hier is `n paar dinge om in gedagte te hou wanneer jy inligting soek:
- Die volume van die produk wat gebruik gaan word
- Die volume van die verdunningsmiddel wat gebruik moet word
- Die tipe verdunningsmiddel om te gebruik (gewoonlik water)
- Spesiale menginstruksies
- Jy sal waarskynlik geen sien inligting oor die presiese konsentrasies van die vloeistowwe wat gebruik word. Hierdie inligting is oorbodig vir die gemiddelde verbruiker.

2. Voeg die verdunningsmiddel by die gekonsentreerde oplossing. Vir eenvoudige huishoudelike verdunnings, soos dié wat jy dalk in die kombuis doen, is al wat jy regtig moet weet voordat jy begin die hoeveelheid konsentraat wat jy gebruik en die benaderde finale konsentrasie wat jy wil verkry. Verdun die konsentraat met die toepaslike hoeveelheid verdunningsmiddel (wat bepaal word relatief tot die aanvanklike volume van die konsentraat wat gebruik is. Sien onder:

3. Jy kan die volume van poeiers in die meeste gevalle ignoreer. Poeier (soos sekere drankmengsels) wat by vloeistowwe gevoeg word, moet gewoonlik nie as `n `verdunning` beskou word nie. Die volumeverandering as gevolg van die byvoeging van `n klein hoeveelheid poeier by `n vloeistof is gewoonlik klein genoeg om te ignoreer. Met ander woorde, deur klein hoeveelhede poeier by `n vloeistof te voeg, voeg jy eenvoudig die poeier by die finale volume vloeistof wat jy wil bereik.
Waarskuwings
- Volg alle veiligheidsriglyne soos aangedui deur die vervaardigingsmaatskappy of jou maatskappy. Dit is veral belangrik as jy wil `n suuroplossing verdun.
- Werk met `n suur oplossing kan meer gedetailleerde stappe en veiligheidsriglyne vereis as om nie-suur oplossings te verdun.
Artikels oor die onderwerp "Verdunningsoplossings"
Оцените, пожалуйста статью
Gewilde