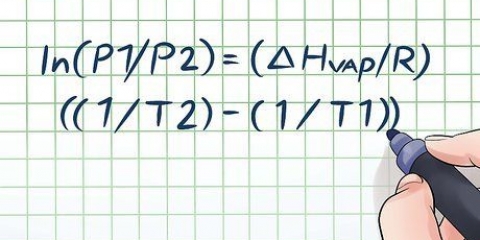Die konvensie is om massa in gram of, as daar voldoende massa is, in kilogram te meet. As gevolg van die klein massa van gasse word hulle ook gemeet in `n ander vorm van massa, naamlik molekulêre massa of molêre massa. Molêre massa word gedefinieer as die som van die atoommassa van elke atoom in die samestelling waaruit die gas bestaan, en vergelyk elke atoom met die waarde 12 vir koolstof. Aangesien atome en molekules te klein is om mee te werk, word `n hoeveelheid gas gedefinieer as die aantal Mol. Die aantal mol teenwoordig in `n gegewe gas kan gevind word deur die massa deur die molêre massa te deel, en dit word voorgestel deur die letter n. Ons kan die arbitrêre konstante k in die gasvergelyking vervang met die produk van n, die aantal Mol en `n nuwe konstante R. Die vergelyking kan nou geskryf word as nR = PV/T of PV = nRT. Die waarde van R hang af van die eenhede wat gebruik word om die druk, volume en temperatuur van gasse te meet. Gebaseer op die volume in liter, die temperatuur in grade Kelvin en die druk in atmosfeer, is die waarde daarvan 0,0821 l atm/K mol. Dit kan opgemerk word as 0,0821 L atm. K mol om die verdelingsteken in die eenhede te vermy. 
Dalton se wet kan in die vorm van `n vergelyking geskryf word as Ptotaal = P1 + bl2 + bl3 …met soveel byvoegings aan die einde van die gelyke-teken as wat daar gasse in die mengsel is. Dalton se wet kan uitgebrei word wanneer daar met gasse gewerk word waarvan die individuele parsiële druk onbekend is, maar waarvan die volume en temperatuur bekend is. Die parsiële druk van `n gas is dieselfde as die druk van daardie gas wanneer dit die enigste gas in die houer is. Vir enige parsiële druk kan ons die ideale gasvergelyking herskryf sodat in plaas daarvan om die formule PV = nRT te gebruik, ons slegs P aan die linkerkant van die gelykteken het. Om dit te doen, verdeel ons beide kante deur V: PV / V = nRT / V. Die twee V`e aan die linkerkant kanselleer mekaar uit, en laat ons met P = nRT/V. Ons kan dan enige geval van P aan die regterkant van die parsiële drukvergelyking plaas met `n subskripsie: Ptotaal =(nRT/V) 1 + (nRT/V) 2 + (nRT/V) 3 .. 


Elke atoom van die eerste gas, stikstof (N2), het `n atoomgewig van 14. Aangesien die stikstof diatomies is (dit vorm diatomiese molekules), moet ons 14 met 2 vermenigvuldig om te bereken dat die stikstofkonsentrasie in die monster `n molêre massa van 28 het. Dan deel ons die massa, 10 g, deur 28, en kry die aantal mol, wat ons afrond tot 0,4 mol stikstof. Elke atoom in die tweede gas, suurstof (O2), het `n atoomgewig van 16. Suurstof is ook diatomies, so ons vermenigvuldig 16 met 2 en vind dat die suurstof in ons voorbeeld `n molêre massa van 32 het. Deel 10 g deur 32 en ons kry ongeveer 0,3 mol suurstof as `n antwoord. Die derde gas, koolstofdioksied (CO2), het 3 atome: `n koolstofatoom met `n atoomgewig van 12 en twee suurstofatome, elk met `n atoomgewig van 16. Ons tel die drie gewigte bymekaar: 12 + 16 + 16 = 44 is die molêre massa. Deel 10 g deur 44 en ons kry ongeveer 0,2 mol koolstofdioksied as antwoord. 
Ter wille van eenvoud het ons die eenhede van die waardes weggelaat. Hierdie eenhede sal tydens die berekening teen mekaar verreken word, wat slegs die eenheid oorbly om die druk te vertoon. 

Vir die parsiële druk van stikstof vermenigvuldig ons 0,4 mol met ons konstante 0,0821 en die temperatuur van 310 grade K, en deel dan deur 2 liter: 0,4 * 0,0821 * 310 / 2 = 5,09 atm. (ongeveer). Vir die parsiële druk van suurstof vermenigvuldig ons 0,3 mol met die konstante 0,0821 en ons temperatuur van 310 grade K, weer deel deur 2 liter: 0,3 * 0,0821 * 310 / 2 = 3,82 atm. (ongeveer). Vir die parsiële druk van koolstofdioksied vermenigvuldig ons 0,2 mol met die konstante van 0,0821 en ons temperatuur van 310 grade K, wat ons weer deur 2 liter deel: 0,2 * 0,0821 * 310 / 2 = 2, 54 atm. (ongeveer). Tel nou elke druk bymekaar vir die totale druk: Ptotaal = 5,09 + 3,82 + 2,54, of 11,45 atm. (ongeveer). 

0.4 + 0.3 + 0.2 = 0.9 mol van die gasmengsel. Dit vereenvoudig die vergelyking verder in: Ptotaal = 0.9*0.0821*310/2. 

Daar is 0,4 mol stikstof, dus 0,4 / 0,9 = 0,44 (44 persent) van die monster (ongeveer). Daar is 0,3 mol suurstof, dus 0,3 / 0,9 = 0,33 (33 persent) van die monster (ongeveer). Daar is 0,2 mol koolstofdioksied, dus 0,2 / 0,9 = 0,22 (22 persent) van die monster (ongeveer). Alhoewel die bogenoemde geskatte persentasies op 0.99 uitkom, bly die desimale in werklikheid herhaal, dus is die som eintlik `n herhalende reeks van nege na die desimale punt. Per definisie is dit dieselfde as 1, of 100 persent. 
Vermenigvuldig 0,44 * 11,45 = 5,04 atm. (ongeveer). Vermenigvuldig 0,33 * 11,45 = 3,78 atm. (ongeveer). Vermenigvuldig 0,22 * 11,45 = 2,52 atm. (ongeveer).
Bereken gedeeltelike druk
Inhoud
In chemie verwys "gedeeltelike druk" na die druk wat enige gas in `n gasmengsel op sy omgewing uitoefen, soos `n Erlenmeyer-fles, `n duiker se suurstofsilinder of die grens van die atmosfeer. Jy kan die druk van elke gas in `n mengsel afsonderlik bereken as jy weet hoeveel van daardie gas teenwoordig is, watter volume dit beslaan en wat sy temperatuur is. Jy kan dan hierdie parsiële druk bymekaar tel vir die totale druk van die gasmengsel, of jy bereken eers die totale druk en bepaal dan die parsiële druk van elke gas.
Trappe
Deel 1 van 3: Verstaan die eienskappe van gasse

1. Behandel enige gas as `n `ideale` gas. `n Ideale gas in chemie is een wat met ander gasse in wisselwerking tree sonder om na hul molekules aangetrek te word. Individuele molekules kan mekaar soos biljartballe tref en weerkaats, sonder om op enige manier te vervorm.
- Die druk van ideale gasse neem toe wanneer hulle in kleiner ruimtes ingedruk word en neem af wanneer hulle meer spasie kry. Hierdie verhouding word Boyle`s Law genoem, vernoem na Robert Boyle. Die vergelyking is k = P x V, of meer algemeen, k = PV, waar k die konstante verwantskap is, P die druk en V die volume is.
- Druk kan in enige van die moontlike meeteenhede gegee word. Een moontlikheid is die Pascal (Pa), gedefinieer as die krag van een Newton op `n vierkante meter. Nog een is die atmosfeer (atm.), gedefinieer as die druk van die atmosfeer op seevlak. `n Druk van 1 atm. is gelyk aan 101,325 Pa.
- Die temperatuur van `n ideale gas styg of daal met die volume van die gas. Hierdie verhouding word Charles`s Law genoem, vernoem na Jacques Charles. Wiskundig skryf jy dit as k = V / T, waar k die konstante verhouding tussen die volume en die temperatuur is, V die volume en T die temperatuur is.
- In hierdie vergelyking word die temperatuur vir gasse uitgedruk in grade Kelvin, wat omgeskakel kan word deur 273 by die aantal grade Celsius by te tel.
- Hierdie twee verhoudings kan gekombineer word in `n enkele vergelyking: k = PV / T, wat ook geskryf kan word as PV = kT.

2. Definieer die hoeveelhede waarin die gasse gemeet word. Gasse het beide massa en volume. Volume word gewoonlik in liter (l) gemeet, maar daar is twee soorte massa.

3. Verstaan Dalton se wet van gedeeltelike druk. Dalton se wet, soos sy naam aandui, is ontwikkel deur chemikus en fisikus John Dalton, wat die eerste was wat die idee ontwikkel het dat chemiese elemente uit atome bestaan, en stel dat die totale druk van `n gasmengsel gelyk is aan die som van die druk van elk van die gasse in die mengsel.
Deel 2 van 3: Berekening van gedeeltelike en dan totale druk

1. Definieer die parsiële drukvergelyking vir die gasse waarmee jy werk. Vir die doeleindes van hierdie berekening, neem ons aan dat `n 2 liter Erlenmeyer-fles 3 gasse bevat: stikstof (N)2), suurstof (O2) en koolstofdioksied (CO2). Elke gas weeg 10 g en die temperatuur van elke gas in die Erlenmeyer-fles is 37 grade Celsius. Ons moet die parsiële druk van elke gas en die totale druk wat die gasmengsel op die fles uitoefen, bepaal.
- Ons vergelyking van die parsiële druk word nou Ptotaal = Pstikstof + blsuurstof + blkoolstofdioksied.
- Aangesien ons probeer om die druk van elke gas te bepaal, ons ken sy volume en temperatuur, en ons kan bereken hoeveel mol van elke gas teenwoordig is gebaseer op sy massa, kan ons hierdie vergelyking soos volg herskryf: Ptotaal =(nRT/V) stikstof + (nRT/V) suurstof + (nRT/V) koolstofdioksied

2. Skakel die temperatuur om na grade Kelvin. Die temperatuur is 37 grade Celsius, so ons voeg 273 by en kry 310 grade K.

3. Bepaal die aantal mol van elke gas wat in die monster teenwoordig is. Die aantal mol van `n gas is die massa van daardie gas gedeel deur sy molêre massa, die som van die atoommassa van elke atoom in sy samestelling.

4. Vul die waardes vir die mol, volume en temperatuur in die vergelyking in. Ons vergelyking lyk nou so: Ptotaal=(0,4 * R * 310 / 2)stikstof+(0,3*R*310/2)suurstof+(0,2 * R * 310 / 2)koolstofdioksied.

5. Voer die waarde vir die konstante R in. Ons gaan die gedeeltelike en totale druk in atmosfeer rapporteer, dus gaan ons die waarde vir R van 0,0821 L atm/K mol gebruik. Prop hierdie waarde in die vergelyking en ons kry die antwoord: Ptotaal gee=(0,4 * 0,0821 * 310 / 2)stikstof+(0,3*0,0821*310/2)suurstof+(0,2 * 0,0821 * 310 / 2)koolstofdioksied.

6. Bereken die parsiële druk vir elke gas. Noudat ons die waardes het, is dit tyd om die wiskundige berekeninge te doen.
Deel 3 van 3: Berekening van die totale en gedeeltelike druk

1. Definieer die parsiële drukvergelyking soos voorheen. Weereens, kom ons neem aan `n 2 liter Erlenmeyer-fles met 3 gasse: stikstof (N)2), suurstof (O2), en koolstofdioksied (CO2). Daar is 10 g van elke gas, en die temperatuur van elke gas in die fles is 37 grade Celsius.
- Die Kelvin-temperatuur is steeds ongeveer 310 grade, en soos voorheen het ons ongeveer 0,4 mol stikstof, 0,3 mol suurstof en 0,2 mol koolstofdioksied.
- Net so sal ons weer die druk in atmosfeer aanteken, dus gebruik 0,0821 L atm/K mol as die waarde vir die R konstante.
- Die parsiële drukvergelyking lyk dus steeds dieselfde op hierdie punt: Ptotaal=(0,4 * 0,0821 * 310 / 2)stikstof+(0,3*0,0821*310/2)suurstof+(0,2 * 0,0821 * 310 / 2)koolstofdioksied.

2. Voeg die mol van elke gas in die monster bymekaar om die totale mol in die gasmengsel te bepaal. Aangesien die volume en temperatuur dieselfde is vir elke monster in die gas, om nie te praat dat elke molêre waarde met dieselfde konstante vermenigvuldig word nie, kan ons die distributiewe eienskap van wiskunde gebruik om die vergelyking as P te herskryftotaal = (0,4 + 0,3 + 0,2) * 0,0821 * 310 / 2.

3. Bepaal die totale druk van die gasmengsel. 0,9 * 0,0821 * 310 / 2 = 11,45 mol (ongeveer).

4. Bepaal hoeveel elke gas uit die totale gasmengsel uitmaak. Jy doen dit deur die totale aantal mol deur die aantal mol van elke gas te deel.

5. Vermenigvuldig die proporsionele hoeveelheid van elke gas met die totale druk om die parsiële druk te bepaal.
Wenke
- U sal basies `n klein verskil in die waardes sien vanaf die parsiële druk en dan die totale druk, in vergelyking met die bepaling van die totale druk eers en dan die parsiële druk. Hou in gedagte dat die waardes wat aangedui word benaderings is, as gevolg van afronding tot 1 of 2 desimale plekke (sodat dit makliker is om te verstaan. As jy self die berekeninge met `n sakrekenaar doen sonder om af te rond, sal jy óf `n kleiner verskil tussen die twee metodes opmerk, óf geen verskil nie.
Waarskuwings
- Kennis van gedeeltelike druk van gasse kan lewe of dood vir duikers wees. `n Te lae gedeeltelike druk van suurstof kan bewusteloosheid of dood veroorsaak, terwyl `n te hoë gedeeltelike druk van beide stikstof en suurstof ook giftig kan wees.
Benodigdhede
- Sakrekenaar
- Naslaanboek oor atoomgewigte/molmassas
Artikels oor die onderwerp "Bereken gedeeltelike druk"
Оцените, пожалуйста статью
Gewilde