Die water moet diep genoeg wees om die elektrodepunt onder te dompel. Laat die monster vir `n rukkie staan om die temperatuur te laat stabiliseer. Meet die temperatuur van die monster met `n termometer. 








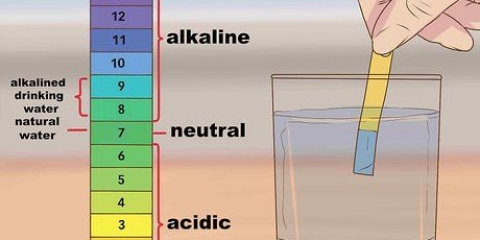
Dit word gewoonlik beskou as `n skaal wat loop van 0 tot 14 (alhoewel stowwe inderdaad buite hierdie reeks kan val). Neutrale stowwe behaal ongeveer 7, suurstowwe daal onder 7 en alkaliese stowwe bo 7. Die pH-skaal is logaritmies, wat beteken verskille van een heelgetal verteenwoordig `n tienvoudige verskil in suurheid of alkaliniteit. Byvoorbeeld, `n stof met `n pH van 2 is tien keer suurder as `n stof met `n pH van 3, en 100 keer suurder as `n stof met `n pH van 4. Die skaal werk op dieselfde manier met alkaliese stowwe, met elke heelgetal wat `n tienvoudige verskil verteenwoordig. 
Dit word oor die algemeen aanbeveel om die pH op die terrein te toets. As jy `n watermonster vir laboratoriumnavorsing neem, kan koolstofdioksied (CO2) uit die lug in die water oplos. Die opgeloste koolstofdioksied reageer met die ione in die water en verhoog die suurheid in basiese of neutrale oplossings. Om besoedeling met koolstofdioksied te vermy, moet die water binne twee uur na versameling getoets word.
Meting van die suurheid van water
Inhoud
Dit is belangrik om die pH-die graad van suurheid of alkaliniteit-van water te meet. Water word gebruik deur die plante en diere waarvan ons afhanklik is, en ons drink dit self elke dag. Die pH-waarde van water kan moontlike besoedeling aandui, dus kan die meting van die pH van water `n belangrike voorsorgmaatreël vir openbare gesondheid wees.
Trappe
Metode 1 van 3: Gebruik `n pH-meter

1. Kalibreer die sonde en meter volgens fabrieksinstruksies. Jy sal dalk die meter moet kalibreer met `n stof met `n bekende pH-waarde. Die maat kan volgens daardie materiaal aangepas word. As jy water buite `n laboratorium gaan toets, word dit aanbeveel om hierdie kalibrasie `n paar uur voor veldtoetsing uit te voer.
- Spoel die sonde uit met skoon water voor gebruik. Droog met `n skoon lap.

2. Neem `n watermonster en gooi dit in `n skoon houer.

3. Verstel die meter met die temperatuur van die monster. Die sensitiwiteit van die sonde word deur die watertemperatuur beïnvloed, so die lesing kan slegs akkuraat wees as jy die temperatuurdata invoer.

4. Plaas die sonde in die monster. Wag vir die meter om ewewig te bereik. Die meter is in `n toestand van ewewig wanneer die meting stabiel is.

5. Lees die pH-lesing van die monster. Die pH-meter gee die resultaat op `n skaal van 0-14. As die water skoon is, is die waarde ongeveer 7. Skryf jou bevindinge neer.
Metode 2 van 3: Gebruik lakmoespapier

1. Leer die verskil tussen pH-papier en lakmoespapier. Jy kan pH-papier gebruik om `n akkurate lesing van `n monster te kry. pH-papier moet egter nie met gewone lakmoespapier verwar word nie. Albei kan gebruik word om vir sure en basisse te toets, maar hulle verskil op belangrike maniere.
- pH-stroke bevat `n reeks indikatorstawe wat van kleur verander wanneer dit aan `n oplossing blootgestel word. Die sterkte van die sure en basisse op elke staaf verskil. Na die verandering kan die kleurpatroon vergelyk word met die monsters wat saam met die stel kom.
- Lakmoespapier is `n papierstrook wat `n suur of basis (alkalies) bevat. Die mees algemene bande is rooi (met `n suur wat met basisse reageer) en blou (met `n basis wat met sure reageer). Die rooi stroke word blou wanneer die stof alkalies is, en die blou stroke word rooi wanneer die stof suur is. Lakmoespapier kan as `n vinnige en maklike toets gebruik word, maar die goedkoopste variante gee nie altyd `n akkurate maatstaf van oplossingsterkte nie.

2. Neem `n monster van die water en gooi dit in `n skoon houer. Die water moet diep genoeg wees om die strook onder te dompel.

3. Doop `n toetsstrook in die monster. ’n Paar sekondes se blootstelling is genoeg. Die aanwyserstawe op die papier sal na `n paar oomblikke van kleur verander.

4. Vergelyk die einde van die toetsstrook met die kleurkaart wat saam met die papier gekom het. Die kleur of kleure op die kaart moet ooreenstem met die kleur of kleure op die toetsstrook. Die kleurkaart bring dan die kleurpatrone in verband met pH-vlakke.
Metode 3 van 3: Verstaan pH

1. Leer hoe sure en basisse gedefinieer word. Suurheid en alkaliniteit (die term wat gebruik word om basisse te beskryf) word beide gedefinieer deur die waterstofione wat hulle skenk of opneem. `n Suur is `n stof wat waterstofione skenk (of `skenk`), en `n basis is `n stof wat bykomende waterstofione opneem.

2. Verstaan die pH-skaal. Die pH-getal word gebruik om die graad van suurheid of alkaliniteit van wateroplosbare stowwe te meet. Water het gewoonlik dieselfde hoeveelheid hidroksiedione (OH−) en hidroniumione (H3O+). Die verhouding van hidroksied- en hidroniumione verander wanneer `n suur of alkaliese stof by die water gevoeg word.

3. Leer hoekom ons die pH van water toets. Suiwer water het `n pH van 7, maar Nederlandse kraanwater het gewoonlik `n pH van tussen 7,5 en 8,3. Hoogs suur water (water met `n lae pH-waarde) is meer geneig om giftige chemikalieë op te los. Dit kan die water besoedel en dit onveilig maak om te drink.
Artikels oor die onderwerp "Meting van die suurheid van water"
Оцените, пожалуйста статью
Gewilde